NORMA
OFICIAL MEXICANA NOM-243-SSA1-2010, PRODUCTOS Y SERVICIOS. LECHE, FORMULA LACTEA,
PRODUCTO LACTEO COMBINADO Y DERIVADOS LACTEOS. DISPOSICIONES Y ESPECIFICACIONES
SANITARIAS. METODOS DE PRUEBA
FICHA
TECNICA NORLEX
Nombre
corto: 27091010.
Legislación: Federal.
Fuente: D.O.F.
Emite: SSA.
Fecha
de publicación:
27 de septiembre de 2010.
Fecha
de entrada en vigor:
26 de noviembre de 2010.
Modificaciones:
Fecha
de publicación Fecha de
entrada en vigor
30 de mayo de
2011 31 de mayo de 2011
Reformas: Tabla 5.
26 de
diciembre de 2012 27 de
diciembre de 2012
Reformas: La denominación y los numerales 1.1; 1.2; 3.1;
3.11; 3.41; 4.2; 4.3; 5; 6.1.5.6; 6.1.5.10; las tablas 2, 3, 4 y 5; 6.1.9;
6.2.1; 9.1 y 9.13.
Derogaciones: Numerales 3.21; 3.29;
3.30; 3.44 y el Apéndice Normativo A.
Adiciones: Numerales 3.38 bis y
3.43 bis.
26
de junio de 2015 20 de
junio de 2016
Derogaciones: Capítulo B.13 Determinación de Listeria monocytogenes, del APENDICE
NORMATIVO B, mediante Artículo Primero Transitorio de la Norma Oficial Mexicana
NOM-210-SSA1-2014, Productos y Servicios. Métodos de Prueba Microbiológicos.
Determinación de Microorganismos Indicadores. Determinación de Microorganismos
Patógenos, publicada en el Diario Oficial de la Federación el 26 de junio de
2015.
26
de junio de 2015 18 de
septiembre de 2016
Derogaciones: Capítulo B.18 Estimación de la
Densidad Microbiana por la Técnica del Número Más Probable de Bacterias
Coliformes, Coliformes fecales y Escherichia
coli, por la Técnica de Diluciones en Tubo Múltiple, del APENDICE NORMATIVO
B METODOS DE PRUEBA, mediante Artículo Segundo Transitorio de la Norma Oficial
Mexicana NOM-210-SSA1-2014, Productos y Servicios. Métodos de Prueba
Microbiológicos. Determinación de Microorganismos Indicadores. Determinación de
Microorganismos Patógenos, publicada en el Diario Oficial de la Federación el
26 de junio de 2015.
26 de junio de 2015 17 de diciembre de 2016
Derogaciones: Capítulos B.11 Determinación de Staphylococcus aureus y B.12 Determinación
de Salmonella spp, del APENDICE NORMATIVO B, mediante Artículo Tercero Transitorio de la
Norma Oficial Mexicana NOM-210-SSA1-2014, Productos y Servicios. Métodos de
Prueba Microbiológicos. Determinación de Microorganismos Indicadores.
Determinación de Microorganismos Patógenos, publicada en el Diario Oficial de
la Federación el 26 de junio de 2015.
Al margen un sello con el Escudo Nacional, que dice: Estados Unidos Mexicanos.- Secretaría de Salud.
MIGUEL ANGEL TOSCANO VELASCO, Comisionado
Federal para
CONSIDERANDO
Que en cumplimiento a lo previsto en el
artículo 46 fracción I de
Que con fecha 23 de junio de 2008, en
cumplimiento del acuerdo del Comité y lo previsto en el artículo 47 fracción I,
de
Que con fecha previa, fueron publicadas en el
Diario Oficial de
Que en atención a las anteriores consideraciones,
contando con la aprobación del Comité Consultivo Nacional de Normalización de
Regulación y Fomento Sanitario, he tenido a bien expedir y ordenar la
publicación de la siguiente:
NORMA OFICIAL MEXICANA
NOM-243-SSA1-2010. PRODUCTOS Y SERVICIOS. LECHE, FORMULA LACTEA, PRODUCTO
LACTEO COMBINADO Y DERIVADOS LACTEOS. DISPOSICIONES Y ESPECIFICACIONES
SANITARIAS. METODOS DE PRUEBA
PREFACIO
En la elaboración de la presente Norma
Oficial Mexicana participaron las siguientes unidades administrativas, organismos
e instituciones:
SECRETARIA DE SALUD
Comisión Federal para
UNIVERSIDAD NACIONAL AUTONOMA DE MEXICO
Programa Universitario de Alimentos
INSTITUTO POLITECNICO NACIONAL
Escuela Nacional de Ciencias Biológicas
LICONSA, S.A. DE C.V.
CONSEJO PARA EL FOMENTO DE
CAMARA NACIONAL DE
CAMARA NACIONAL DE INDUSTRIALES DE
ASOCIACION DE GANADEROS PRODUCTORES DE LECHE
PURA, S.A DE C.V.
DANONE DE MEXICO, S.A. DE C.V.
GRUPO CHEN
UNILEVER DE MEXICO, S DE R.L. DE C.V.
INDICE
1. Objetivo y Campo de Aplicación
2. Referencias
3. Definiciones
4. Clasificación
5. Símbolos y Abreviaturas
6. Especificaciones sanitarias
7. Muestreo
8. Métodos de prueba
9. Etiquetado
10. Concordancia con normas internacionales
11. Bibliografía
12.
Observancia de la norma
13. Vigencia
Apéndice Normativo A. Eliminado (D.O.F. el 26 de
diciembre de 2012)
Apéndice Normativo B. Métodos de Prueba
Apéndice Informativo A. Lista de sustancias desinfectantes
recomendadas.
Apéndice Informativo B. Procedimiento de limpieza y descontaminación
del material de vidrio y área de trabajo para la determinación de aflatoxinas.
1.
Objetivo y Campo de Aplicación
1.1 Esta Norma Oficial Mexicana establece las especificaciones sanitarias y nutrimentales que debe cumplir la leche, producto lácteo, producto lácteo combinado, mezcla de leche con grasa vegetal y los derivados lácteos.
1.2 Esta Norma Oficial Mexicana es de observancia obligatoria en el territorio nacional para las personas físicas o morales que se dedican al proceso e importación de la leche, producto lácteo, producto lácteo combinado, mezcla de leche con grasa vegetal y derivados lácteos.
2.
Referencias
Esta
norma se complementa con las siguientes normas oficiales mexicanas o las que
las sustituyan:
2.1 Norma Oficial Mexicana NOM-051-SCFI/SSA1-2010 Especificaciones generales de etiquetado para alimentos y bebidas no alcohólicas preenvasados - Información comercial y sanitaria.
2.2 Norma Oficial Mexicana NOM-086-SSA1-1994 Bienes y servicios. Alimentos y bebidas no alcohólicas con modificaciones en su composición. Especificaciones nutrimentales.
2.3 Norma Oficial Mexicana NOM-127-SSA1-1994 Salud Ambiental, agua para uso y consumo humano-Límites permisibles de calidad y tratamientos a que debe someterse el agua para su potabilización.
2.4 Norma Oficial Mexicana NOM-130-SSA1-1995 Bienes y servicios. Alimentos envasados en recipientes de cierre hermético y sometidos a tratamiento térmico. Disposiciones y especificaciones sanitarias.
2.5 Norma Oficial Mexicana NOM-155-SCFI-2012 Leche–Denominaciones, especificaciones fisicoquímicas, información comercial y métodos de prueba.
2.6 Norma Oficial Mexicana NOM-183-SCFI-2012 Producto lácteo y producto lácteo combinado- Denominaciones, especificaciones fisicoquímicas, información comercial y métodos de prueba.
2.7 Norma Oficial Mexicana NOM-190-SCFI-2012 Mezcla de leche con grasa vegetal - denominaciones, especificaciones fisicoquímicas, información comercial y métodos de prueba.
2.8 Norma Oficial Mexicana NOM-251-SSA1-2009 Prácticas de higiene para el proceso de alimentos, bebidas o suplementos alimenticios.
3.
Definiciones
Los términos en los que se
definen y clasifican los productos específicos no son denominaciones
comerciales y su aplicación se relaciona exclusivamente con el control
sanitario.
Para efectos de esta Norma
Oficial Mexicana se entiende por.
3.1
Aditivo alimentario (Aditivo): cualquier sustancia que en cuanto tal
no se consume normalmente como alimento, ni tampoco se usa como ingrediente
básico en alimentos, tenga o no valor nutritivo, y cuya adición al producto con
fines tecnológicos en sus fases de producción, elaboración, preparación,
tratamiento, envasado, empaquetado, transporte o almacenamiento, resulte o
pueda preverse razonablemente que resulte (directa o indirectamente) por sí o
sus subproductos, en un componente del producto o un elemento que afecte a sus
características (incluidos los organolépticos). Esta definición no incluye "contaminantes"
o sustancias añadidas al producto para mantener o mejorar las cualidades
nutricionales.
3.2
Alimento y bebida no alcohólicas con modificaciones en su composición, al que ha sufrido cambios en su composición
por adición, disminución o eliminación de uno o más de sus nutrimentos, tales
como hidratos de carbono, proteínas, lípidos, vitaminas, minerales o fibra; y
que forman parte de la dieta habitual.
3.3
Azúcares, a todos los mono y
disacáridos presentes en un alimento o bebida no alcohólica.
3.4
Bases o mezclas para helados,
es la emulsión cuya composición se ajusta al helado, según sea el caso,
pudiendo presentarse en forma líquida, concentrada o en polvo.
3.5
Bitácora o registro, al
documento controlado que provee evidencia objetiva y auditable de las
actividades ejecutadas o resultados obtenidos durante el proceso del producto y
su análisis.
3.6
Buenas prácticas de fabricación, en particular para el caso de los aditivos se refiere a la cantidad
mínima indispensable para lograr el efecto deseado.
3.7
Congelación, método de
conservación físico que se efectúa por medio de equipo especial para lograr una
reducción de la temperatura de los productos objeto de esta norma en su centro
térmico a máximo
3.8
Consumidor, persona física o
moral que adquiere o disfruta como destinatario final productos alimenticios y
bebidas no alcohólicas preenvasados.
3.9
Contaminantes, entidades
físicas, químicas o biológicas indeseables, que se encuentran en el producto,
por arriba de los límites permisibles.
3.10
Crema, al producto terminado
en el que se ha reunido una fracción determinada de grasa y sólidos no grasos
de la leche, ya sea por reposo, por centrifugación o reconstitución sometida a
pasteurización y cualquier otro tratamiento térmico que asegure su inocuidad.
3.11
Derivados lácteos, productos obtenidos a partir de la leche o sus
componentes y otros ingredientes funcionalmente necesarios para su elaboración,
incluidos los productos con grasa vegetal.
3.12
Deshidratación, al
tratamiento que consiste en la eliminación de agua de un producto.
3.13
Dulces a base de leche, a
los productos elaborados por tratamiento térmico de la leche y edulcorantes,
pudiendo ser adicionados de aditivos e ingredientes opcionales.
3.14
Edulcorante, sustancia que produce la sensación de
dulzura, de orígenes naturales o sintéticos.
3.15
Envasado aséptico, al
proceso que reúne las condiciones de esterilidad comercial para evitar la
presencia de microorganismos en el producto durante el envasado.
3.16
Envase, cualquier recipiente,
o envoltura en el cual está contenido el producto preenvasado para su venta al
consumidor.
3.17
Esterilización comercial, al
tratamiento térmico aplicado al producto para la destrucción de todos los
microorganismos viables de importancia en la salud pública y aquellos capaces
de reproducirse en el alimento bajo condiciones normales de almacenamiento y
distribución, sin la condición de refrigeración.
3.18
Etiqueta, marbete rótulo,
inscripción, marca, imagen gráfica u otra forma descriptiva, que se haya escrito,
impreso, estarcido, marcado, en relieve o en hueco, grabado, adherido,
precintado o anexado al empaque o envase del producto.
3.19
Fecha de caducidad, a la
fecha límite en que se considera que un producto preenvasado almacenado en las
condiciones establecidas por el fabricante, mantiene las características
sanitarias que debe reunir para su consumo. Después de esta fecha no debe
comercializarse ni consumirse.
3.20 Fecha de consumo preferente, fecha en que, bajo determinadas condiciones de almacenamiento, expira el periodo durante el cual el producto preenvasado es comercializable y mantiene las cualidades específicas se le atribuyen tácita o explícitamente, pero después de la cual el producto preenvasado puede ser consumido.
3.21
Eliminado (D.O.F. el 26 de diciembre de 2012)
3.22
Función tecnológica, efecto
que produce el uso de aditivos en los alimentos y bebidas no alcohólicas
preenvasados, que proporciona o intensifica su aroma, color o sabor, y/o mejora
su estabilidad y conservación, entre otros. Véase aditivo.
3.23
Helado, alimento producido
mediante la congelación con o sin agitación de una mezcla pasteurizada
compuesta por una combinación de ingredientes lácteos pudiendo contener grasas
vegetales, frutas, huevo y sus derivados, saborizantes, edulcorantes y otros
aditivos; cuando está empalillado se nombrará paleta.
3.24
Información nutrimental, toda
descripción destinada a informar al consumidor sobre las propiedades
nutrimentales de un alimento o bebida no alcohólica preenvasado. Comprende dos aspectos:
a) La declaración nutrimental obligatoria.
b) La declaración nutrimental complementaria.
3.25 Ingrediente,
cualquier sustancia o producto, incluidos los aditivos, que se emplee, en la
fabricación o preparación de un alimento o bebida no alcohólica y esté presente
en el producto final, transformado o no.
3.26
Ingredientes opcionales, a
los que se pueden adicionar a los productos tales como: chiles, condimentos,
especias, frutas, verduras, entre
otros.
3.27
Leche, a la secreción
natural de las glándulas mamarias de las vacas sanas o de cualquier otra
especie animal, excluido el calostro.
3.28
Leche acidificada, a la
obtenida por la acidificación de la leche entera, parcialmente descremada o
descremada, pasteurizada, con agentes acidulantes.
3.29 Leche condensada azucarada, la que ha sido obtenida mediante la evaporación del agua de la leche a través de presión reducida, a la que se le ha agregado sacarosa y/o dextrosa u otro edulcorante natural, hasta alcanzar una determinada concentración de grasa butírica y sólidos totales.
3.30 Leche evaporada, producto obtenido mediante eliminación parcial del agua de la leche por el calor o por cualquier otro procedimiento que permita obtener un producto con la misma composición y características de la leche sin modificación en la proporción entre la caseína y la proteína de la leche.
3.31 Leche fermentada, a la obtenida por la acidificación de la leche estandarizada entera o deshidratada, pasteurizada, parcialmente descremada, semidescremada o descremada, debido a la acción de bacterias lácticas vivas con la consiguiente reducción del pH, adicionada o no por aditivos, por alimentos e ingredientes opcionales.
3.32
Límite máximo, cantidad
establecida de aditivos, microorganismos, parásitos, materia extraña, plaguicidas,
metales pesados y metaloides, entre otros, que no se debe exceder en un
alimento, bebida o materia prima.
3.33
Limpieza, conjunto de
procedimientos que tiene por objeto eliminar tierra, residuos, suciedad, polvo,
grasa u otras sustancias objetables.
3.34
Lote, a la cantidad de un
producto, elaborado en un mismo ciclo, integrado por unidades homogéneas.
3.35
Mantequilla, al producto
obtenido a partir de la grasa de la leche o grasa de la crema, la cual ha sido
pasteurizada, sometida a maduración, fermentación o acidificación, batido o
amasado, pudiendo ser o no adicionada de sal. El contenido de grasa butírica
debe ser mínimo de 80%.
3.36
Materia extraña, a cualquier
sustancia, resto, desecho o material que se presenta en el producto pero que no
forma parte de la composición normal de éste.
3.37
Metal pesado, a los
elementos químicos que causan efectos indeseables en el metabolismo aun en
concentraciones bajas. Su toxicidad depende de la dosis en que se ingieran, así
como su acumulación en el organismo.
3.38 Método de prueba, al procedimiento analítico utilizado para comprobar que
un producto satisface las especificaciones que establece la norma.
3.38 bis. Mezcla de Leche con grasa
vegetal, producto elaborado a partir de la leche, a la cual se le sustituye la
mayor parte de la grasa butírica por grasa vegetal comestible, en las
cantidades necesarias para ajustar el producto a las especificaciones de
composición y sensoriales propias de su denominación, conforme a lo establecido
en la NOM-190-SCFI-2012 citada en el apartado de referencias.
3.39
Muestra, al total de
unidades de producto provenientes de un lote y que representan las
características y condiciones del mismo.
3.40
Pasteurización, al
tratamiento térmico al que se someten los productos, consistente en una
relación de temperatura y tiempo que garantice la destrucción de organismos
patógenos y la inactivación de algunas enzimas de los alimentos.
3.41
Planta procesadora, al establecimiento dedicado al proceso de
pasteurización, ultrapasteurización, esterilización, deshidratación,
rehidratación, entre otros procesos de la leche, producto lácteo, producto
lácteo combinado y mezcla de leche con grasa vegetal.
3.42
Proceso, al conjunto de
actividades relativas a la obtención, elaboración, fabricación, preparación,
conservación, mezclado, acondicionamiento, envasado, manipulación, transporte,
distribución, almacenamiento y expendio o suministro al público de los
productos objeto de esta norma.
3.43
Producto a granel, al
producto que debe pesarse, medirse, o contarse en presencia del consumidor por
no encontrarse preenvasado al momento de su venta.
3.43 bis Producto lácteo, producto
elaborado a partir de ingredientes propios de la leche, tales como caseína,
grasa, suero de leche, agua para uso y consumo humano, con un mínimo de 22g/L
de proteína de la leche y, de ésta, el 80% de caseína, puede contener grasas de
origen vegetal en las cantidades necesarias para ajustarlo a las
especificaciones de composición y sensoriales propias de su denominación
establecidas en la NOM-183-SCFI-2012 citada en el apartado de referencias.
3.44
Producto lácteo combinado,
el producto elaborado a partir de sólidos lácteos y otros ingredientes, el cual
debe contener como mínimo 15 g/L de proteína propia de la leche y, de ésta, el
80% de caseína, además de cumplir con las especificaciones de composición y
sensoriales propias de su denominación establecidas de la NOM-183-SCFI-2012
citada en el apartado de referencias.
3.45
Prueba de esterilidad comercial, a la retención temporal de las muestras representativas de los
productos bajo condiciones de tiempo y temperatura establecidas para verificar
la esterilidad comercial del producto.
3.46
Quesos, productos elaborados
de la cuajada de leche estandarizada y pasteurizada de vaca o de otras especies
animales, con o sin adición de crema, obtenida de la coagulación de la caseína
con cuajo, gérmenes lácticos, enzimas apropiadas, ácidos orgánicos comestibles
y con o sin tratamiento ulterior, por calentamiento, drenada, prensada o no,
con o sin adición de fermentos de maduración, mohos especiales, sales fundentes
e ingredientes comestibles opcionales, dando lugar a las diferentes variedades
de quesos pudiendo por su proceso ser: fresco, madurado o procesado.
3.47
Quesos frescos, aquellos que
además de cumplir con la descripción general de queso se caracterizan por su
alto contenido de humedad, y por no tener corteza o tener corteza muy fina,
pudiendo o no adicionarles aditivos e ingredientes opcionales.
3.48
Quesos madurados, aquellos
que además de cumplir con la descripción general de queso, se caracterizan por
ser de pasta dura, semidura o blanda y pueden tener o no corteza; sometidos a
un proceso de maduración mediante adición de microorganismos, bajo condiciones
controladas de tiempo, temperatura y humedad, para provocar en ellos cambios
bioquímicos y físicos característicos del producto del que se trate, lo que le
permite prolongar su vida de anaquel, los cuales pueden o no requerir
condiciones de refrigeración.
3.49
Quesos procesados, aquellos
que además de cumplir con la descripción general de queso se caracterizan por
ser elaborados con mezclas de quesos, fusión y emulsión con sales fundentes,
aditivos para alimentos permitidos e ingredientes opcionales, sometidos a
proceso térmico de
3.50
Quesos de suero, productos
obtenidos a partir del suero de leche entera, semidescremada, o descremada pasteurizada
de vaca, cabra u oveja, el cual es coagulado por calentamiento en medio ácido
para favorecer la obtención de la cuajada, la que es salada, drenada, moldeada,
empacada y etiquetada y posteriormente refrigerada para su conservación.
3.51
Refrigeración, al método de
conservación físico con el cual se mantienen los productos a una temperatura
máxima de
3.52
Rehidratación, al
procedimiento mediante el cual se restituye el agua a los productos
deshidratados objeto de esta norma.
3.53
Sorbete, producto que cumple
con la definición de helado, excepto en que su contenido de grasa, sólidos no
grasos y sólidos totales, son inferiores a los del helado.
3.54
Suero de leche, líquido
obtenido de la coagulación de la caseína de la leche, mediante la acción de
enzimas coagulantes de origen animal, vegetal o microbiano, por la adición de
ácidos orgánicos o minerales de grado alimentario; acidificación por
intercambio iónico hasta alcanzar el punto isoeléctrico de la caseína.
3.55
Tratamiento térmico, al
método físico que consiste en someter a una fuente de calor suficiente por un
tiempo apropiado al producto, antes o después de ser envasado con el fin de
lograr una estabilidad biológica y que garantice la eliminación de
microorganismos patógenos.
3.56
Ultrapasteurización, al
proceso al cual es sometido el producto a una adecuada relación de temperatura
y tiempo, envasado asépticamente para garantizar la esterilidad comercial.
4.
Clasificación
Los productos objeto de esta
norma por su proceso se clasifican de la siguiente manera, la cual no corresponde a una denominación:
4.1
Leche
4.1.1
Pasteurizada
4.1.2
Ultrapasteurizada
4.1.3
Esterilizada
4.1.4
Deshidratada
4.2 Mezcla de leche con grasa vegetal
4.2.1 Pasteurizada
4.2.2 Ultrapasteurizada
4.2.3 Esterilizada
4.2.4 Deshidratada
4.3 Producto lácteo o Producto lácteo combinado
4.3.1 Pasteurizado
4.3.2 Ultrapasteurizado
4.3.3 Esterilizado
4.3.4 Deshidratado
4.4
Quesos
4.4.1 Frescos
4.4.1.1 Frescales: Panela, Canasto, Sierra, Ranchero, Fresco, Blanco,
Enchilado, Adobado.
4.4.1.2 De pasta cocida: Oaxaca, Asadero, Mozzarela, Del Morral, Adobera.
4.4.1.3 Acidificados: Cottage, Crema, Doble crema, Petit Suisse,
Nuefchatel.
4.4.1.4 Quesos de suero:
Broccio, Broccotle, Cerrase, Geitmysost, Gyetost, Mejetle, Mysost, Recuit,
Requesón, Ricotta, Picotón, Schottenezinger, Zinder.
4.4.2 Madurados
4.4.2.1 Madurados prensados de pasta dura: Añejo, Parmesano, Cotija,
Reggianito.
4.4.2.2 Madurados prensados: Cheddar, Chester, Chihuahua, Manchego, Brick,
Edam, Gouda, Gruyere, Emmental, Cheshire, Holandés, Amsterdam, Butterkase,
Coulomiers, Dambo, Erom, Friese, Fynbo, Havarti, Harzer-Kase, Herrgardsost,
Huskallsost, Leidse, Maribo, Norvergia, Provolone, Port Salut, Romadur, Saint
Paulin, Samsoe, Svecia, Tilsiter, Bola, Jack.
4.4.2.3 De maduración con mohos: Azul, Cabrales, Camembert, Roquefort,
Danablu, Limburgo, Brie.
4.4.3 Procesados
4.4.3.1 Fundidos
4.4.3.2
Fundidos para untar
4.4.4 Otros quesos: frescos, madurados y
procesados no considerados en los numerales 4.4.1, 4.4.2 y 4.4.3, deberán
observar lo dispuesto en este ordenamiento.
4.5
Mantequilla
4.6
Cremas
4.6.1
Pasteurizadas
4.6.2
Ultrapasteurizadas
4.6.3
Esterilizadas
4.6.4
Deshidratadas
4.6.5
Acidificadas
4.6.6
Fermentadas
4.6.7
Batidas y para batir
4.7
Leche condensada azucarada
4.8
Leche fermentada o
acidificada
4.9
Dulces a base de leche
4.9.1
Dulces de baja humedad
(menos del 12%) o endurecidos: caramelos, chiclosos, jamoncillos, etc.
4.9.2
Dulces de humedad intermedia
(12-20%) que se procesan mediante evaporación: glorias, cajeta y obleas con
cajeta, etc.
4.9.3
Dulces de alta humedad (más
de 20%), procesados por coagulación, aireación y procesos enzimáticos: flanes,
gelatinas, chongos, mousse, arroz con leche, etc.
4.10
Helados y Sorbetes
4.10.1
Helados de crema
4.10.2
Helados de leche
4.10.3
Helados de grasa vegetal
4.10.4
Sorbetes
4.10.5
Bases para helados y
sorbetes
4.11
Otros productos lácteos no
considerados, deberán observar lo dispuesto en este
ordenamiento.
5. Símbolos y Abreviaturas
|
AFM1 |
aflatoxina M1 |
|
BPF |
buenas
prácticas de fabricación |
|
cm |
centímetro |
|
cm2 |
centímetro
cuadrado |
|
ci |
color
index |
|
conc. HACCP |
concentración análisis
de peligros y de puntos críticos de control (por su siglas en inglés). |
|
HPLC |
cromatografía
de líquidos de alta eficacia |
|
ºC |
grados
Celsius |
|
G |
gramo |
|
X g |
gravedad
(en centrifugado) |
|
H |
hora |
|
= |
igual |
|
1/d |
inversa
de la dilución |
|
kg |
kilogramo |
|
Lb |
libra |
|
L |
litro |
|
+ |
más |
|
M |
masa |
|
± |
más-menos |
|
Máx. |
máximo |
|
> |
mayor
que |
|
< < |
menor
que igual
o menor que |
|
|
micra |
|
µg |
microgramo |
|
µL |
microlitro |
|
mg |
miligramo |
|
µm |
micrómetro |
|
mL |
mililitro |
|
min |
minutos |
|
mm |
milímetro |
|
mM |
milimolar |
|
M |
molar |
|
m/v |
masa
a volumen |
|
ng |
nanogramo |
|
nm |
nanómetro |
|
N |
normal |
|
No. |
número |
|
/ |
por |
|
% |
por ciento |
|
pH |
potencial
de hidrógeno |
|
Pulg |
pulgada |
|
rpm |
revoluciones
por minuto |
|
seg |
segundos |
|
X |
signo
de multiplicación |
|
UF |
unidades
de fenol |
|
UFC |
unidades
formadoras de colonias |
|
UI |
unidades
internacionales |
|
UV |
ultravioleta |
|
V |
volumen |
|
v/v |
volumen
a volumen |
Cuando en la presente norma se mencione:
Acuerdo, debe entenderse que se trata del Acuerdo por el que se
determinan los aditivos y coadyuvantes en alimentos, bebidas y suplementos
alimenticios, su uso y disposiciones sanitarias.
·
Reglamento,
debe entenderse que se trata del Reglamento de Control Sanitario de Productos y
Servicios.
6.
Especificaciones sanitarias
6.1
Generales
Los productos objeto de esta norma, además de
cumplir con lo establecido en el Reglamento, deben ajustarse a las siguientes
disposiciones:
6.1.1
Los establecimientos que se
dediquen al proceso e importación de los productos comercializados en el
Territorio Nacional objeto de esta norma, deben cumplir con lo establecido en
6.1.2
Todos los ingredientes que
se utilicen para la elaboración de los productos objeto de esta norma, deben
cumplir con las especificaciones sanitarias establecidas en el Reglamento y las
normas oficiales mexicanas correspondientes.
6.1.3
Los productos que se
modifiquen en su composición, deben cumplir con lo establecido en
6.1.4
Los productos sujetos a
tratamiento térmico y envasados en recipientes de cierre hermético, además de
cumplir con lo establecido en este ordenamiento, deben cumplir con
6.1.5
La leche, que se
comercialice para su consumo humano o que se emplee como materia prima para la
elaboración de productos lácteos debe cumplir con lo siguiente:
6.1.5.1
No presentar materias
extrañas, conservadores ni sustancias neutralizantes.
6.1.5.2
No coagular por ebullición.
6.1.5.3
Presentar prueba de alcohol
al 68% negativa (sólo para leche de bovino).
6.1.5.4
Presentar prueba de
inhibidores bacterianos, negativa; detectados por métodos fisicoquímicos y
microbiológicos, de conformidad con la tabla 1 del presente ordenamiento.
Tabla 1. Inhibidores bacterianos en leche.
|
PRODUCTO |
Derivados
Clorados |
Sales
cuaternarias de amonio |
Oxidantes |
Formaldehído |
Antibióticos |
|
Pasteurizados |
Negativo |
Negativo |
Negativo |
Negativo |
Negativo |
|
Ultrapasteurizados |
Negativo |
Negativo |
Negativo |
Negativo |
Negativo |
|
0Esterilizados |
Negativo |
Negativo |
Negativo |
Negativo |
Negativo |
6.1.5.5
Debe someterse a un
tratamiento térmico con un tiempo y temperatura determinados que garantice su
inocuidad, independientemente del uso que se le dé posteriormente. A excepción
de la leche que se utilice para la elaboración de quesos que por las
características de éstos no pueda ser sometida a tratamiento térmico, la cual
debe cumplir con lo siguiente:
6.1.5.5.1
Tener implementado un
sistema HACCP para su proceso, conforme a lo establecido en el Apéndice A de
6.1.5.6
Los tratamientos térmicos a los que se someta la leche, producto
lácteo, producto lácteo combinado o mezcla de leche con grasa vegetal para su
comercialización, o antes de su uso como materia prima para el caso de la
leche, pueden ser: ebullición, pasteurización, ultrapasteurización,
esterilización o deshidratación.
Tabla 2. Temperaturas y tiempos para tratamiento térmico de la leche, producto lácteo, producto lácteo combinado o mezcla de leche con grasa vegetal.
|
Tratamiento |
Temperatura y
tiempo* |
|
Pasteurización |
Lenta Rápida |
|
Ultrapasteurización o esterilización |
|
* Puede emplearse alguna otra relación de tiempo-temperatura que sea equivalente para la destrucción de los microorganismos patógenos.
6.1.5.7
El equipo para la
pasteurización lenta debe contar, por lo menos, con un sistema para registro
gráfico o numérico y control de la temperatura y tiempo del proceso, tina con
tapa y sistema de agitación del producto, termómetro de mercurio con vástago de
acero inoxidable funcionando y calibrado, o su equivalente.
6.1.5.8
El equipo empleado para la
pasteurización rápida debe contar, por lo menos, con un sistema de control y
registro automático de la temperatura y tiempo del proceso, que no permita el
paso del producto cuando no se haya alcanzado la temperatura mínima
establecida, así mismo, un sistema en que el flujo del producto cumpla con el
tiempo mínimo determinado. Termómetro de mercurio o su equivalente funcionando
y calibrado, colocado al final de la “zona de sostenimiento” del equipo, en el
que la terminal tenga contacto con el producto.
6.1.5.8.1 La temperatura registrada en el sistema de
control y registro del proceso debe ser <
6.1.5.9
El equipo empleado para la
ultrapasteurización o esterilización, debe contar con dispositivos de control y
registro de temperatura de operación durante el tiempo de producción, que
permita comprobar que los productos han sido sometidos al tratamiento térmico
establecido.
6.1.5.10
Una vez alcanzada la temperatura, la leche, producto lácteo,
producto lácteo combinado o mezcla de leche con grasa vegetal debe enfriarse
rápidamente a una temperatura de 6°C, y manejarse a esta temperatura hasta el
momento del envasado a excepción de productos ultrapasteurizados o
esterilizados
6.1.5.11
Los productos sometidos a
deshidratación deben cumplir con lo siguiente:
a) Los que se utilicen como materia prima, deben ser pasteurizados previamente a la deshidratación.
b) No se podrán vender a granel al consumidor.
6.1.5.12
Los productos sometidos a
rehidratación deben ser pasteurizados, ultrapasteurizados o esterilizados,
conforme a este ordenamiento.
6.1.6
Especificaciones físicas y
químicas
6.1.6.1
Prueba de fosfatasa
residual.
Tabla No. 3. Límite máximo de fosfatasa residual.
|
Producto |
Límite máximo de fosfatasa residual (UF/g) |
|
Leche,
producto lácteo, producto lácteo combinado o mezcla de leche con grasa
vegetal pasteurizado* |
4 |
|
Quesos
frescos, madurados y procesados |
12 |
|
Quesos
de suero |
4 |
|
Helados
de crema, de leche o grasa vegetal, sorbetes y bases o mezclas para helados |
4 |
|
Mantequilla
y cremas pasteurizada** |
4 |
Nota: Se debe considerar que podrán presentar
falsos positivos, por lo que esta prueba no puede ser concluyente.
* No aplica para este tipo de productos
ultrapasteurizados, esterilizados y deshidratados. ** No aplica para leche
condensada azucarada, leche fermentada o acidificada y dulces a base de leche.
6.1.6.2
No deben contener materia
extraña.
6.1.7
Especificaciones de
contaminantes
6.1.7.1
La presencia de
contaminantes en los productos objeto de esta norma no debe rebasar el límite
máximo señalado en la siguiente tabla.
Tabla No. 4. Límites máximos de contaminantes(1)
|
Contaminante |
Límite máximo mg/kg |
|
Arsénico(2) |
0,2 |
|
Plomo |
0,1(3) 0,5(4) |
|
Mercurio |
0,05(3) |
|
Estaño |
250(5) |
|
Aflatoxina
M1 |
0,5mg/L(3) |
(1) No aplica ningún contaminante a los helados, sorbetes y bases o mezclas para helados; (2) No aplica a mantequillas, cremas, leche fermentada y acidificada, leche condensada azucarada, dulces a base de leche; (3) Límite sólo para leche, producto lácteo, producto lácteo combinado y mezcla de leche con grasa vegetal,(4) Límite para quesos (5) Aplica sólo para aquellos productos envasados en hoja de lata sin barniz.
6.1.7.2
El productor o fabricante de
los productos objeto de esta norma, debe establecer mecanismos de control que
permitan determinar la presencia y cantidad de metales pesados y metaloides en
las materias primas o en el producto en proceso de elaboración o en el producto
terminado. Es recomendable establecer una periodicidad de verificación de
mecanismos de control de al menos 1 vez por año, considerando las condiciones
del proceso e instalaciones. La información
generada debe estar a disposición de
6.1.8
Especificaciones
Microbiológicas
6.1.8.1
Los productos objeto de esta
norma no deben exceder los límites de microorganismos señalados a continuación:
Tabla 5. Límites
máximos de contenido microbiano para leche, producto lácteo, producto lácteo combinado, mezcla de leche con grasa
vegetal y derivados lácteos.
|
Microorganismo |
Límite máximo |
Productos |
|
Organismos
Coliformes totales |
<100 UFC/g o mL |
Helados
y sorbetes. Quesos de suero. |
|
<50 UFC/g o mL |
Bases
o mezclas para helados. |
|
|
<20 UFC/g o mL |
En
punto de venta: Leche, producto lácteo, producto lácteo combinado y mezcla de
leche con grasa vegetal; pasteurizados. |
|
|
<10 UFC/g o mL |
En
planta: Leche, producto lácteo, producto lácteo combinado y mezcla de leche
con grasa vegetal; pasteurizados o deshidratados. Mantequilla,
cremas, leche condensada azucarada, leche fermentada o acidificada, dulces a
base de leche. Mantequilla,
cremas, leche condensada azucarada, leche fermentada o acidificada, dulces a
base de leche. |
|
|
Staphylococcus aureus |
<10 UFC/ mL por siembra
directa |
Leche,
producto lácteo, producto lácteo combinado y mezcla de leche con grasa
vegetal; |
|
<100 UFC/g o mL |
Mantequilla,
cremas, leche condensada azucarada, leche fermentada o acidificada, dulces a
base de leche. Quesos
madurados y quesos procesados. |
|
|
1000 UFC/g |
Quesos
frescos y quesos de suero. |
|
|
Salmonella spp |
Ausente en 25g o mL |
Leche,
producto lácteo, producto lácteo combinado y mezcla de leche con grasa
vegetal; pasteurizados y deshidratados. Quesos
frescos, madurados y procesados. Quesos de suero. Cremas,
leche fermentada o acidificada, dulces a base de leche*, helados, sorbetes y
bases para helados. Mantequillas. |
|
Escherichia coli |
100 UFC/g o mL |
Quesos
frescos. |
|
< 3 NMP/g o mL |
Leche
utilizada como materia prima para la elaboración de quesos. Leche,
producto lácteo, producto lácteo combinado y mezcla de leche con grasa
vegetal; deshidratados. |
|
|
< 10 NMP/g |
Quesos
madurados y procesados. |
|
|
Listeria monocytogenes |
Ausente en 25g o mL |
Leche,
producto lácteo, producto lácteo combinado y mezcla de leche con grasa
vegetal; pasteurizados.** Quesos.
Quesos de suero. Helados,
bases para helados y sorbetes** |
|
Vibrio cholerae *** |
Ausente en 25g |
Quesos
frescos. Helados,
sorbetes y bases para helados. |
|
|
Ausente en 50g |
Quesos
de suero. |
|
Enterotoxina estafilococcica |
Negativa |
Leche,
producto lácteo, producto lácteo combinado y mezcla de leche con grasa
vegetal; deshidratados y la que se emplee como materia prima para elaboración
de quesos. Quesos
frescos, madurados y procesados. Helados,
sorbetes y bases para helados. |
|
Toxina botulínica** |
Negativa |
Quesos
frescos, madurados y procesados, envasados al alto vacío. |
|
Mohos y levaduras |
500 UFC/g o mL |
Quesos
frescos, madurados*** y quesos de suero. |
|
100 UFC/g o mL |
Quesos
procesados. |
|
|
50 UFC/g o mL |
Bases
o mezclas para helados. |
|
|
Mesofílicos aerobios |
200,000 UFC/g o mL |
Helados
y sorbetes. |
|
100,000 UFC/g o mL |
Bases
para helado. |
* Para aquellos que contienen chocolate, cocoa, coco,
huevo y semillas.
** Se determinará únicamente en situaciones de
emergencia sanitaria, cuando la SSA de acuerdo a los resultados microbiológicos
detecte su presencia, y ordenará la realización de un plan de trabajo por parte
del fabricante o importador para controlar la presencia.
*** Aquellos productos que para su maduración requieren
de hongos, pudieran estar fuera de este límite.
6.1.9
Aditivos
6.1.9.1
En la elaboración de los productos objeto
de esta norma se podrán utilizar los aditivos listados en el Acuerdo, bajo las
especificaciones establecidas en el mismo.
6.1.10
Control documental del
proceso:
6.1.10.1
Los registros de tratamiento
térmico deben ser continuos y contar con la siguiente información:
Tabla
6. Información mínima de los
procedimientos, bitácoras o registros de las diferentes etapas del proceso.
|
DOCUMENTO |
INFORMACION |
|
Bitácora o registro de Proceso |
- Control de tratamiento térmico. ·
Gráficas de temperatura y tiempo de tratamiento térmico
(pasteurización, ultrapasteurización o esterilización, deshidratación), por
equipo. ·
Temperatura y tiempo de enfriamiento. ·
Cantidad e identificación del producto - Registro de los hechos no comunes. |
|
Procedimiento
de operaciones de limpieza y desinfección de equipos para tratamiento
térmico. |
- Personal encargado de la operación. - Frecuencia - Vigencia. |
|
Bitácora
o Registro de operaciones de limpieza y desinfección de equipo para
tratamiento térmico. |
- Registro de los hechos no
comunes. |
|
Diagrama
de proceso |
- Etapas de proceso con tiempos y
temperaturas de cada operación. |
6.2
Específicas
Además de las especificaciones sanitarias
generales señaladas en el numeral 6.1 de este ordenamiento; se debe cumplir con
lo siguiente:
6.2.1
Leche, producto lácteo, producto lácteo combinado y mezcla de leche
con grasa vegetal.
6.2.1.1
Deben contener de
6.2.1.2
Los productos adicionados con
Vitamina A o D3 no
deben contener cantidades superiores a las establecidas en este ordenamiento.
6.2.1.3
Los productos deshidratados
deben contener una humedad no mayor al 4%.
6.2.1.4
Los productos sometidos a
ultrapasteurización o esterilización deben cumplir con lo siguiente:
6.2.1.4.1
Ser envasados asépticamente
en envases que cuenten con barreras para proteger el producto del oxígeno y la
luz, y llenarse en ausencia de aire.
6.2.1.4.2
El cierre de los envases
debe ser hermético y llevar a cabo las pruebas para su control y los registros
correspondientes.
6.2.1.4.3
El envase que se emplee,
debe someterse a un tratamiento de desinfección.
6.2.1.4.4
Los agentes desinfectantes
deben tener actividad esporicida, no degradar el material del envase, se deben
evaporar fácilmente de la superficie del envase y no deben reaccionar con el
producto.
6.2.1.4.5
Sólo se permite el uso de
peróxido de hidrógeno para efectos de desinfección de los envases, éste debe
emplearse en una concentración de 30 al 50%.
6.2.1.4.6
Los establecimientos deben
destinar un área de incubación para la prueba de esterilidad comercial para
efectos del control interno de una muestra representativa de la producción, de
la cual se debe tomar una submuestra para someterse a análisis microbiológicos.
6.2.2
Cremas
6.2.2.1
Las cremas acidificadas y
fermentadas deben tener una acidez titulable de no menos de 0,5% expresada como
ácido láctico.
6.2.2.2
Las cremas deshidratadas
deben contener una humedad no mayor al 4%.
6.2.3
Leche fermentada o acidificada.
6.2.3.1
Las leches fermentadas o
acidificadas deben tener una acidez titulable de no menos de 0,5% expresada
como ácido láctico y su pH debe ser máximo de 4,5.
6.2.4
Helados, bases para helados
y sorbetes
6.2.4.1
Para la elaboración de
helados y sorbetes se permite la incorporación de aire limpio como coadyuvante
en su elaboración.
6.2.4.2
No se permite volver a
congelar los productos después de haber sido descongelados.
6.2.4.3
La mezcla para elaborar los
helados, bases para helados y sorbetes debe pasteurizarse de la siguiente
forma:
6.2.4.3.1
Deben someterse a una
temperatura de
6.2.4.3.2
Serán sometidas a una
temperatura de
6.2.4.3.3
Someterlas a otra relación
de tiempos y temperaturas cuyo efecto sea el mismo.
6.2.4.3.4
En cualquiera de los casos,
una vez alcanzados, respectivamente, las temperaturas y tiempos señalados se
enfriará bruscamente a
6.2.4.3.5
Una vez pasteurizadas las
mezclas, deben mantenerse a una temperatura máxima de
7.
Muestreo
7.1 El
procedimiento de muestreo para los productos objeto de esta norma, debe
sujetarse a lo que establece
8.
Métodos de Prueba
Para la verificación oficial de las
especificaciones que se establecen en esta norma, se deben aplicar los métodos
de prueba señalados en el apéndice normativo B de este ordenamiento.
9. Etiquetado
La etiqueta de los productos objeto de esta
norma, además de cumplir con lo establecido en el Reglamento y
9.1 En la superficie principal de
exhibición de los envases de leche, producto lácteo, producto lácteo combinado
y mezcla de leche con grasa vegetal, debe declararse el tratamiento térmico al
que fue sometido, así como otros tratamientos aplicados para asegurar la
inocuidad del producto, establecidos en otros ordenamientos legales
correspondientes.
9.2
En los productos objeto de
esta norma que contienen sal yodada, debe declararse como tal en la lista de
ingredientes.
9.3
Cuando en la elaboración de
los productos objeto de esta norma, se emplee leche que no procede de vaca, se
debe indicar su origen.
9.4
Los quesos deben indicar el
contenido de grasa butírica.
9.5
Los productos objeto de esta
norma a excepción de los helados, bases para helados y sorbetes deben indicar
“fecha de caducidad”.
9.6
Si la identificación del
lote corresponde a la fecha de caducidad, se deben indicar las leyendas: “Lote” y “Fecha de caducidad” o sus
abreviaturas o sus equivalentes.
9.7
En la etiqueta de productos
pasteurizados y de aquellos que requieren refrigeración para su conservación,
se debe incluir la siguiente leyenda: "Manténgase en refrigeración" o
"Consérvese en refrigeración" o cualquier otra equivalente.
9.8
En el caso de los helados,
sorbetes y otros productos que requieren congelación debe figurar la leyenda
"Manténgase en congelación" o "Consérvese en congelación" o
cualquier otra equivalente.
9.9
Para productos
deshidratados: “Consérvese en un lugar fresco y seco”, "Una vez preparado
el producto, manténgase o consérvese en refrigeración" o cualquier otra
equivalente.
9.10
Para dulces a base de leche
de humedad baja e intermedia, debe indicarse “Manténgase en lugar fresco y
seco”, o cualquier otra equivalente.
9.11
Los productos
ultrapasteurizados o esterilizados deben de incluir las leyendas “Manténgase o
consérvese en lugar fresco y seco”. “No requiere refrigeración en tanto no se
abra el envase”. “Refrigérese después de abrirse” o leyendas equivalentes.
9.12
Los productos objeto de esta
norma que hayan sido modificados en su composición nutrimental, deben ostentar
junto a la denominación, con el mismo tipo y tamaño de letra, la modificación
que lo caracterice.
9.13
La leche, producto lácteo, producto lácteo combinado y mezcla de
leche con grasa vegetal, adicionados con vitamina D o con vitaminas A y D,
según corresponda, deben hacer figurar su contenido con las siguientes
leyendas:
9.13.1 "Contiene _______ mg de Vitamina D por L", o
9.13.2
"Contiene _______ mg de Vitamina D y _______ mg equivalentes de retinol (Vitamina
A)/L".
9.13.3 En el espacio en blanco debe figurar el
contenido de dichos nutrimentos, o sus equivalentes por
9.13.4
El texto, “Adicionada con
Vitamina D” para los productos adicionados con Vitamina D3.
9.13.5 Cuando voluntariamente se señalen dentro de
la declaración nutrimental, deben figurar como se señala a continuación:
Tabla 8
|
Nutrimento |
Cantidad por |
|
Vitamina
A |
mg equivalentes de retinol |
|
Vitamina
D |
mg |
9.14
Los productos con
modificación en su composición deben cumplir con lo señalado en
9.15 Cálculo de vitaminas
9.15.1 Vitamina A
1 UI de vitamina A es equivalente a 0,3 g equivalentes de
retinol (todos los Retinoles “trans”).
9.15.2 Vitamina D3
1UI de
vitamina D3 es equivalente a 0,025 g de colecalciferol.
9.16
Leyendas precautorias
9.16.1 Los productos que contengan alcohol etílico
o bebidas alcohólicas en cantidades superiores al 0,5%, deben incluir en la
superficie principal de exhibición de la etiqueta, la siguiente leyenda: “Este
producto contiene ______% de alcohol. No recomendable para niños”. (En el
espacio en blanco citar el contenido de alcohol en %).
9.17 La cantidad de proteínas que ha de
indicarse, debe calcularse utilizando la siguiente fórmula:
Leche, derivados o productos lácteos y quesos
Proteína = contenido total de nitrógeno
Kjeldahl X 6.38
Dulces a base de leche, Helados, Sorbetes:
Proteína = contenido total de nitrógeno
Kjeldahl X 6.25
9.18 En el caso de que los productos objeto de
esta norma contengan o incluyan productos preenvasados como parte de
promociones u obsequios, tales como productos de panificación, cereales,
chocolate u otros alimentos, deben incluir en el envase del producto de
promoción u obsequio, cuando menos la siguiente información: lista de
ingredientes, identificación del responsable del producto, fecha de caducidad y
lote.
9.19 Cuando en las etiquetas se declaren u
ostenten en forma escrita, gráfica o descriptiva que los productos, su uso,
aplicación, ingredientes o cualquier otra característica están recomendados,
respaldados o aceptados por centros de investigación, asociaciones,
organizaciones, entre otros, los cuales deberán contar con reconocimiento
nacional o internacional de su experiencia y estar calificados para dar opinión
sobre la información declarada. Se deberá contar con el sustento técnico
respectivo, el que estará a disposición de
9.20
Los productos destinados a
ser reconstituidos o los contenidos en envases que requieran instrucciones de
uso o consumo especiales, deben incluir una descripción escrita o gráfica de
las instrucciones de uso, empleo o preparación.
9.21 Los productos envasados en punto de venta,
deben ostentar la siguiente información:
9.21.1
Nombre o denominación del
producto.
9.21.2
Fecha de envasado y, en su
caso, fecha de caducidad, señalando
el día y el mes y anteponiendo la leyenda que corresponda “fecha de envasado
_____”, “fecha de caducidad _____”, o leyenda equivalente.
10.
Concordancia con normas internacionales
Esta norma es parcialmente equivalente a las
siguientes normas:
10.1
Codex Alimentarius. CODEX
STAN 232-2001. Norma Nivel Máximo para
10.2
Codex Alimentarius. CODEX
STAN A-9-1976, Rev. 1-2003. Norma del Codex Para Las Natas (Cremas) Y Las Natas
(Cremas) Preparadas.
10.3
Codex Alimentarius. CODEX
STAN A-6-1978, Rev. 1-1999, enmendado en 2006. Norma del General del Codex para
el Queso.
10.4
Codex Alimentarius. CODEX
STAN 221-2001. Norma colectiva para el Queso No Madurado, Incluido el Queso
Fresco.
11.
Bibliografía
11.1 Ley
Federal sobre Metrología y Normalización.
11.2 Reglamento
de
11.3 Ley
General de Salud.
11.4 Reglamento
de Control Sanitario de Productos y Servicios.
11.5 Norma
Oficial Mexicana NOM-008-SCFI-1994. Sistema general de unidades de medida.
México, D.F.
11.6 Guía
para la redacción, estructuración y presentación de las normas oficiales
mexicanas. NORMA-Z-13/02.
11.7 Food and Drug Administration.
Grade "A" Pasteurized Milk Ordinance. (2003 Revision). Department of
Health and Human and Services. U.S.A.
11.8
Fernández Escartín, E. 2000. "Microbiología e inocuidad de los Alimentos”. Universidad
Autónoma de Querétaro.
11.9 Food and
Agriculture Organization of the United Nations. 1994. “Summary of evaluations
performed by the Joint FAO/WHO Expert Committee on Food Additives (JECFA)”.
ILSI Press, Washington.
11.10 U.S.
Food & Drug Administration. 2001. Center for Food Safety & Apllied Nutrition.
Foodborne pathogenic microorganisms and natural toxins handbook. “Bad bug book”.
11.11 Secretaría de Salud. Dirección General de
Control Sanitario de Bienes y Servicios. Aplicación de Análisis de Riesgos,
Identificación y Control de Puntos Críticos en
11.12 Secretaría de Salud. Dirección General de
Control Sanitario de Bienes y Servicios. Pasteurización de
11.13 Norma Mexicana NMX-F-703-COFOCALEC-2004,
Sistema de producto leche –alimentos- lácteos –leche y producto lácteo (o
alimento lácteo)- fermentado o acidificado –denominaciones, especificaciones y
métodos de prueba.
11.14 Norma Mexicana NMX-F-709-COFOCALEC-2004,
Sistema producto leche –alimento- alimento lácteo regional- chongos zamoranos y
producto lácteo tipo chongos zamoranos –denominaciones, especificaciones y
métodos de prueba.
12.
Observancia de la norma
12.1
La vigilancia del cumplimiento de la presente norma corresponde a
13.
Vigencia
13.1 La presente Norma Oficial Mexicana entrará
en vigor a los 60 días naturales posteriores a la fecha de su publicación en el
Diario Oficial de
Transitorio
Unico: Con la entrada en vigor de la presente Norma
Oficial Mexicana se cancelan las siguientes normas oficiales mexicanas:
·
NOM-035-SSA1-1993,
Bienes y servicios. Quesos de suero. Especificaciones sanitarias, publicada en
el Diario Oficial de
·
NOM-036-SSA1-1993,
Bienes y servicios. Helados de crema, de leche o grasa vegetal, sorbetes y
bases o mezclas para helados. Especificaciones sanitarias, publicada en el
Diario Oficial de
·
NOM-121-SSA1-1994,
Bienes y servicios. Quesos: frescos, madurados y procesados. Especificaciones
sanitarias, publicada en el Diario Oficial de
·
NOM-184-SSA1-2002,
Productos y servicios. Leche, fórmula láctea y producto lácteo combinado.
Especificaciones sanitarias, publicada en el Diario Oficial de
·
NOM-185-SSA1-2002,
Productos y servicios. Mantequilla, cremas, producto lácteo condensado
azucarado, productos lácteos fermentados y acidificados, dulces a base de
leche. Especificaciones Sanitarias, publicada en el Diario Oficial de
Sufragio Efectivo. No Reelección.
México,
Distrito Federal, a 25 de junio de 2010.- El
Comisionado Federal para
APENDICE NORMATIVO A
Eliminado (D.O.F. el 26 de diciembre de 2012)
APENDICE NORMATIVO B
B.
METODOS DE PRUEBA
Precauciones
generales de seguridad.
El analista debe consultar siempre la
información respecto a la exposición y manejo seguro de los reactivos químicos
especificados en estos métodos, para emplear el equipo de seguridad apropiado
como bata de laboratorio, guantes de látex, anteojos de seguridad, mascarilla,
etc., y trabajar cuando así se requiera bajo campana de extracción.
Para la aplicación de los siguientes métodos
analíticos se debe cumplir con las Buenas Prácticas de Laboratorio.
B.1.
Recolección de la muestra
Utilizar un frasco estéril de vidrio o de
plástico provisto de tapón de cierre hermético, libre de fenol. Se recomienda
el empleo de tapones de hule. Transportar la muestra en una hielera con
refrigerante para lograr una temperatura de
B.2.
Preparación de la muestra
Antes de proceder al estudio fisicoquímico de
la leche, homogeneizar la muestra por agitación e inversión repetida del
recipiente que la contiene. En los casos que se observe la formación de grumos,
calentar la muestra en baño de agua a temperatura aproximada de
Mantener la leche a
B.3.
Determinación de Inhibidores
B.3.1.
Derivados Clorados (prueba cualitativa).
B.3.1.1.
Principio del método.
Cuando la muestra es tratada con ácido, se
libera el cloro presente, si este cloro se hace reaccionar con yoduro de
potasio y solución de almidón se desarrolla un color azul cuya intensidad va a
depender de la cantidad de cloro presente.
B.3.1.2.
Equipo.
B.3.1.2.1. Baño de agua a
B.3.1.3.
Materiales.
B.3.1.3.1. Tubos de ensaye de 16 x
B.3.1.3.2. Pipetas graduadas de 10 mL.
B.3.1.3.3. Agitadores de vidrio.
B.3.1.3.4. Embudos de filtración.
B.3.1.3.5. Papel filtro.
B.3.1.3.6. Baño de hielo.
B.3.1.4.
Reactivos.
Los reactivos que a continuación se mencionan
deben ser grado analítico a menos
que se indique otra especificación y por agua debe entenderse agua destilada.
B.3.1.4.1.
Yoduro de potasio (KI).
Solución al 7%.
B.3.1.4.2.
Acido clorhídrico (HCl)
diluido 1:2. A 100 mL de ácido clorhídrico agregar 200 mL de agua.
B.3.1.4.3.
Solución de almidón (C6H10O5)n. Suspender 1g de almidón en un poco de agua
fría, homogeneizar y agregarlo a 100 mL de agua hirviendo, agitar hasta
disolución completa, enfriar antes de usar. Utilizar solución recientemente
preparada.
B.3.1.5. Procedimiento.
B.3.1.5.1. En un tubo de ensaye poner 5 mL de leche y
agregarle 1,5 mL de solución de yoduro de potasio al 7%, agregar 4 mL de HCl
diluido y mezclar perfectamente con una varilla de vidrio. Incluir una muestra
control.
B.3.1.5.2. Colocar los tubos en un baño de agua a
B.3.1.6.
Interpretación de resultados.
La aparición de un color azul grisáceo que va
desde el azul hasta el azul morado (de acuerdo con la concentración de cloro
presente), indica la presencia de cloro.
B.3.1.7.
Expresión de resultados.
|
Prueba positiva o negativa |
B.3.2.
Sales Cuaternarias de Amonio (prueba cualitativa).
B.3.2.1.
Principio del método
Cuando se hace reaccionar el ion cuaternario
de amonio en medio alcalino con un indicador (anaranjado de metilo) se forma un
complejo que es extraído con cloroformo, el cual en medio ácido da un color magenta.
B.3.2.2.
Materiales
B.3.2.2.1. Matraces Erlenmeyer de 125 mL.
B.3.2.2.2. Mortero de porcelana de
B.3.2.2.3. Embudos de filtración.
B.3.2.2.4. Tubos de ensaye.
B.3.2.2.5. Pipetas graduadas de 10 mL.
B.3.2.3.
Reactivos.
Los reactivos que a continuación se mencionan
deben ser grado analítico a menos
que se indique otra especificación y por agua debe entenderse agua destilada.
B.3.2.3.1. Anaranjado de metilo (C14H14N3NaO3S). Solución acuosa al 0,15%.
B.3.2.3.2. Solución acuosa de hidróxido de
sodio (NaOH). Disolver
B.3.2.3.3. Cloroformo (CHCl3).
B.3.2.3.4. Sulfato de sodio anhidro (Na2SO4).
B.3.2.3.5. Acido clorhídrico (HCl) 2N.
B.3.2.3.6. Cloruro de benzalconio [cloruro de
n-alquil-(C12 a C18) bencildimetil amonio, con un
intervalo de peso molecular de 351-380 y conteniendo cadenas de los grupos
alquilo con 12 y 16 átomos de carbono], al 0,06%. Para prepararlo considerar la
concentración inicial del reporte del fabricante.
B.3.2.4.
Procedimiento.
B.3.2.4.1.
Colocar 25 mL de leche en un
matraz Erlenmeyer, agregar 0,5 mL de solución acuosa de anaranjado de metilo, 1
mL de solución acuosa de hidróxido de sodio y 20 mL de cloroformo, agitar 3
min.
B.3.2.4.2.
Pasar la emulsión resultante
a un mortero al que previamente se le han agregado
B.3.2.4.3.
Preparar una solución
control de color, colocando en un matraz Erlenmeyer 25 mL de leche y 0,5 mL de
la solución de cloruro de benzalconio al 0,06%. Proceder igual que en la
muestra.
B.3.2.5.
Interpretación de resultados.
Un color magenta cereza en la capa acuosa es
una prueba positiva de cantidades mayores de 1 mg/kg de sales cuaternarias de
amonio.
B.3.2.6.
Expresión de resultados.
|
Prueba positiva o negativa. |
B.3.3.
Oxidante (prueba cualitativa).
B.3.3.1.
Principio del método.
Está basado en la formación de un compuesto
colorido al hacer reaccionar el agente oxidante (peróxido de hidrógeno) que
contenga la muestra con pentóxido de vanadio en presencia de ácido sulfúrico al
6% (v/v)
B.3.3.2.
Materiales.
B.3.3.2.1. Tubos de ensaye de 15 mL.
B.3.3.2.2. Pipetas graduadas de 5 y 10 mL.
B.3.3.2.3. Probetas de 100 mL.
B.3.3.3.
Reactivos.
Los reactivos que a continuación se mencionan
deben ser grado analítico a menos
que se indique otra especificación y por agua debe entenderse agua destilada.
B.3.3.3.1. Solución de ácido sulfúrico al 6%(v/v)
En un vaso de precipitados medir 94 mL de
agua y lentamente resbalando por las paredes, adicionar 6 mL de H2SO4 concentrado.
B.3.3.3.2. Solución de pentóxido de vanadio (V2O5).
Disolver
B.3.3.4.
Procedimiento.
En un tubo de ensaye medir 10 mL de leche y
agregarle de
B.3.3.5.
Interpretación de Resultados.
La aparición de un color rosa o rojo, indica
la presencia de peróxido de hidrógeno (oxidante).
B.3.3.6.
Expresión de resultados.
|
Prueba positiva o negativa. |
B.3.4.
Determinación de Formaldehído (prueba cualitativa).
B.3.4.1.
Principio del método.
Se basa en la reacción del formaldehído con
la sal disódica del ácido cromotrópico formando una coloración de lila a
púrpura.
B.3.4.2.
Equipo.
B.3.4.2.1 Equipo de destilación Kjeldahl.
B.3.4.3.
Materiales.
B.3.4.3.1. Matraz Kjeldahl de 800 mL.
B.3.4.3.2. Material común de laboratorio.
B.3.4.4.
Reactivos.
Todos los reactivos deben ser grado analítico
a menos que se indique otra especificación y por agua se entiende agua
destilada.
B.3.4.4.1. Acido fosfórico (H3PO4).
B.3.4.4.2.
Sal disódica del ácido
cromotrópico ( C10H8Na2O8S2).
B.3.4.4.3. Acido sulfúrico concentrado (H2SO4).
B.3.4.4.4. Formaldehído (CH2O) al 37%, densidad = 1,08 g/L.
B.3.4.4.5. Solución de ácido sulfúrico al 72%. Verter
150 mL de ácido sulfúrico en 100 mL de agua y enfriar.
B.3.4.4.6. Solución saturada de sal disódica del ácido
cromotrópico. Disolver 500 mg de sal disódica del ácido cromotrópico en 100 mL
de solución de ácido sulfúrico al 72%. Enfriar a temperatura ambiente.
B.3.4.4.7. Solución de formaldehído de 40 mg/L. Tomar 1
mL de formaldehído y aforar a
B.3.4.5.
Procedimiento.
B.3.4.5.1.
En el matraz de Kjeldahl
tomar 100 mL de leche, adicionar 100 mL de agua y acidificar con 2 mL ácido
fosfórico adicionando 1 mL de exceso. Destilar 50 mL.
B.3.4.5.2.
En un tubo de ensaye poner 1
mL del destilado y 5 mL de solución saturada de sal disódica del ácido
cromotrópico, colocarlo en baño maría a ebullición durante 15 minutos. Observar
durante este periodo de calentamiento.
B.3.4.5.3. Preparar una solución control de color,
colocando en un matraz Kjeldahl, 100 mL de leche y 1 mL de solución de
formaldehído. Proceder como se describió en los numerales B.3.4.5.1 y
B.3.4.5.2.
B.3.4.6.
Interpretación de resultados.
La aparición de un color lila hasta púrpura
indica la presencia de formaldehído.
B.3.4.7.
Expresión de resultados.
|
Prueba positiva o negativa. |
B.3.5.
Inhibidores Determinados por Pruebas Microbiológicas (residuos de
antibióticos).
B.3.5.1.
Principio del método.
Las substancias inhibidoras del crecimiento
bacteriano presentes en la leche, se ponen de manifiesto por halos de
inhibición medibles, que se forman cuando se impregnan discos de papel filtro
con la muestra y se depositan sobre la superficie de una placa de agar
inoculado con esporas de B.
stearothermophilus.
B.3.5.2.
Equipo.
B.3.5.2.1. Autoclave.
B.3.5.2.2. Centrífuga (de preferencia
refrigerada).
B.3.5.2.3. Balanza granataria, de dos
platillos, sensibilidad
B.3.5.2.4. Balanza de precisión o analítica,
turbidímetro o uso de estándares de McFarland
B.3.5.2.5. Incubadora con termostato que
evite variaciones mayores a 1,0ºC.
B.3.5.2.6.
Microscopio óptico.
B.3.5.2.7.
Nefelómetro de McFarland.
B.3.5.2.8. Equipo para tinción de Gram y
esporas.
B.3.5.3.
Materiales.
B.3.5.3.1. Asa y portaasa bacteriológicas.
B.3.5.3.2. Cajas Petri de vidrio de 100 X
B.3.5.3.3. Discos de papel de
B.3.5.3.4. Matraces Erlenmeyer de 250 mL.
B.3.5.3.5. Micropipeta con capacidad para
medir 90 L.
B.3.5.3.6. Pinzas de disección con punta
fina.
B.3.5.3.7. Porta objetos y puente de tinción.
B.3.5.3.8. Tubos de cultivo con rosca de 13 X
B.3.5.3.9. Vernier o medidor de halos
B.3.5.3.10. Frascos con tapón de rosca
B.3.5.4.
Reactivos.
Los reactivos que a continuación se mencionan
deben ser grado analítico a menos que se indique otra especificación y por agua
debe entenderse agua destilada.
B.3.5.4.1. Subcultivo de Geobacillus stearothermophilus ATCC10149 o Bacillus calidolactis ATCC 10149.
B.3.5.4.2. Agar
indicador PM.
|
Ingredientes |
Cantidad (g) |
|
Extracto
de carne |
3,0 |
|
Peptona
|
5,0 |
|
Triptona |
1,7 |
|
Soytona |
0,3 |
|
Dextrosa |
5,25 |
|
Cloruro
de sodio |
0,5 |
|
K2HPO4 |
0,25 |
|
Polisorbato
80 |
0,06 |
|
Púrpura
de Bromocresol |
0,06 |
|
Agar |
15,0 |
Preparación:
Disolver los ingredientes en un litro de agua
destilada. Calentar hasta disolución completa del agar. Ajustar el pH, si es
necesario. Esterilizar a
pH final 7,8 + 0,2. Distribuir en
placas como se indica en B.3.5.5.5.
B.3.5.4.3. Caldo
soya tripticasa (CST) sin dextrosa.
|
Ingredientes |
Cantidad (g) |
|
Peptona
de caseína |
17,0 |
|
Peptona
de soya |
3,0 |
|
Cloruro
de sodio |
5,0 |
|
Fosfato
dipotásico |
2,5 |
Preparación:
Disolver los ingredientes en un litro de agua
destilada. Ajustar el pH. Distribuir en frascos en cantidades según se
requiera. Esterilizar en autoclave a
pH final 7,3 + 0,2.
B.3.5.4.4. Agar
Soya Tripticasa (AST).
|
Ingredientes |
Cantidad (g) |
|
Peptona
de caseína |
15,0 |
|
Peptona
de soya |
5,0 |
|
Cloruro
de sodio |
5,0 |
|
Agar |
15,0 |
Preparación:
Disolver los ingredientes en un litro de agua
destilada. Calentar hasta disolución completa de agar. Ajustar el pH, si es
necesario. Esterilizar a
B.3.5.4.5. Penicilinasa (- lactamasa). Se pueden adquirir discos impregnados, de marca comercial
que funcionan satisfactoriamente.
B.3.5.4.6.
Penicilina G (sustancia de
referencia).
B.3.5.4.7. Solución estéril de NaCI al 0,85% (m/v)
(SS).
B.3.5.4.8. Solución amortiguadora de fosfatos, pH 6.
B.3.5.5.
Procedimiento
B.3.5.5.1. Preparación de la solución de trabajo de
Penicilina G de referencia.
Pesar 30 mg de Penicilina G de referencia,
dentro de una atmósfera de humedad relativa menor a 50%. Disolver en solución
amortiguadora de fosfatos para obtener una concentración de 100-1000 Unidades
Internacionales/mL. Almacenar en la oscuridad entre 0-
B.3.5.5.2.
Preparación del inóculo.
B.3.5.5.2.1. Mantener el cultivo de B. stearothermophilus en medio inclinado de AST, haciendo pases
semanales. A partir de este cultivo inocular de
B.3.5.5.2.2. Periódicamente hacer una observación microscópica
para determinar el grado de esporulación del cultivo (aproximadamente el 80%
del cultivo en 72 h, está en fase esporulada). Centrifugar las células a 5000
rpm durante 15 min.
B.3.5.5.2.3. Decantar el sobrenadante y resuspender las
células en SS. Repetir el lavado, suspender las células en 30 mL de SS y
almacenar entre 0-4,0ºC. Esta suspensión puede mantenerse viable durante 6-8
meses. Verificar su viabilidad mediante cultivo en placas de AST.
B.3.5.5.3
Solución estándar de leche.
Diluir la solución de trabajo de Penicilina G
en leche libre de inhibidores para obtener una concentración de 0.008 UI/mL.
Usar recientemente preparado o almacenar entre 0-
B.3.5.5.4.
Control Negativo.
Leche fluida con un contenido de grasa de
0,0% a 3,8% y sólidos totales menos del 13%. Comprobar la ausencia de
sustancias inhibidoras (comercialmente disponible).
B.3.5.5.5.
Preparación de las placas.
B.3.5.5.5.1. Inocular el medio de agar indicador PM,
fundido y enfriado a 55-
B.3.5.5.5.2. Utilizar las placas recientemente preparadas
o almacenar entre 0-
B.3.5.5.6.
Prueba Preliminar.
B.3.5.5.6.1. Agregar 90 µL de la muestra, usando
micropipeta, asegurarse de que las puntas estén bien colocadas, en posición
vertical y en el centro del disco, evitar la introducción de burbujas o colocar
sobre la superficie de la muestra bien mezclada un disco de papel sostenido con
las pinzas, hasta que se impregne completamente por capilaridad. Eliminar
cualquier exceso de leche, tocar ligeramente la superficie interna de la tapa y
colocar el disco inmediatamente sobre la placa de agar. Asegurar un completo
contacto del papel filtro con el agar, presionar con las pinzas suavemente
(repetir esta operación con todas las muestras).
B.3.5.5.6.2. Colocar un disco control en el centro
impregnado con el estándar de leche (0,008 UI/mL de Penicilina G). Marcar e
identificar los controles y las muestras. Se recomienda no colocar más de 7
discos por placa: 6 en la orilla y uno en el centro.
B.3.5.5.6.3. Verificar que todos los discos estén
uniformemente absorbidos sin presentar exceso de leche y colocados en forma
adecuada. Invertir las placas e incubar a 55-
B.3.5.5.6.4. Examinar las zonas de inhibición de las
muestras y medir los halos con vernier. Las zonas de inhibición <
B.3.5.5.7.
Prueba Confirmatoria.
Calentar las muestras a
B.3.5.5.8.
Controles
B.3.5.5.8.1. Cuando se aplica este método, el analista
debe estar seguro de que cualquier grado de actividad antimicrobiana detectada,
proviene de la muestra y nunca de las condiciones ambientales, del equipo o
reactivos usados; ni del propio analista.
B.3.5.5.8.2. Se requiere, por lo tanto, aplicar las
buenas prácticas de laboratorio y los controles adecuados, a lo largo de todo
el análisis.
B.3.5.5.8.3. El control positivo que contiene solución de
referencia de Penicilina G a una concentración de 0,008 UI/mL debe producir
zonas de inhibición claras y bien definidas de aproximadamente 17-
B.3.5.5.8.4. La sensibilidad de este ensayo es
normalmente > 0,008 UI/mL. El control del diluyente, siempre debe dar resultados negativos.
B.3.5.5.9.
Precauciones al realizar la prueba.
B.3.5.5.9.1. Para colocar los discos, utilizar pinzas
limpias y flameadas.
B.3.5.5.9.2. Tocar con el disco la superficie de las
muestras y permitir que el disco se sature por capilaridad. Las pinzas deben
flamearse y enfriarse entre cada muestra.
B.3.5.5.9.3. Tocar la boca del recipiente con el disco,
para eliminar el exceso de leche.
B.3.5.5.9.4. Colocar el disco sobre el agar a una
distancia de aproximadamente
B.3.5.5.9.5. Aplicar el control positivo en el centro de
la placa y el control negativo en cualquiera de los seis lugares de la orilla.
B.3.5.5.9.6. Incubar las placas en posición invertida, en
una cámara húmeda, a la temperatura y el tiempo indicados en la metodología.
B.3.5.5.10.
Precauciones en el uso de la micropipeta.
B.3.5.5.10.1. Homogeneizar la muestra. Fijar la punta a la
micropipeta y en posición vertical oprimir el émbolo hasta el primer tope.
B.3.5.5.10.2. Introducir la punta
B.3.5.5.10.3. Si el émbolo se suelta rápidamente, el
volumen de leche tomado no será uniforme. Si la punta no está llena en forma
correcta, después de soltar el émbolo, descartar y repetir la operación.
B.3.5.6.
Interpretación de los Resultados.
Las pruebas: preliminar y confirmatoria,
pueden dar lugar a los siguientes resultados:
B.3.5.6.1. Ausencia de zonas de inhibición en la prueba
preliminar: la prueba es negativa a sustancias inhibitorias.
B.3.5.6.2. Zonas de inhibición alrededor de discos con
muestra sin penicilinasa y ausencia de zonas de inhibición alrededor de discos
tratados con penicilinasa, en prueba confirmatoria: la prueba es positiva a
residuos de - lactámicos.
B.3.5.6.3. Presencia de zonas de inhibición de igual
tamaño en ambos discos (tratados y no tratados con penicilinasa): prueba
positiva a sustancias inhibidoras diferentes a -lactámicos.
B.3.5.6.4. Presencia de zonas de inhibición de menor
tamaño (
B.3.5.7.
Expresión de Resultados.
|
Prueba positiva o negativa. |
B.4.
Determinación de Fosfatasa Residual en leche, fórmula láctea, producto lácteo
combinado y derivados lácteos.
B.4.1.
Principio del método.
La muestra se incuba con fenilfosfato en
solución reguladora de hidróxido de bario. Si la fosfatasa activa está
presente, el fenilfosfato se hidroliza y se forma fenol.
C6H5OPO3H2 +
H2O![]() C6H5OH
+ H3PO4
C6H5OH
+ H3PO4
Si la leche utilizada en la elaboración del
producto ha sido pasteurizada eficientemente, la fosfatasa se inactiva y no hay
hidrólisis.
El fenol formado se determina
colorimétricamente haciendo reaccionar con 2,6-dibromoquinonacloroimida
(B.Q.C.), obteniéndose un color azul, cuya intensidad se mide
espectrofotométricamente a 610 nm.
B.4.2.
Equipo.
B.4.2.1. Baño de agua con control de temperatura
a 37-
B.4.2.2. Parrilla de calentamiento, de
control termostático.
B.4.2.3. Espectrofotómetro de UV-Visible o
fotocolorímetro disponible para utilizarse a 610 nm con celdas de
B.4.2.4. Balanza analítica con una precisión
de 0,1 mg.
B.4.3.
Materiales.
Todo el material de vidrio utilizado debe
someterse a una temperatura entre 85-
B.4.3.1. Tubos de ensaye de 15 x
B.4.3.2. Tubos de ensaye con graduación de
B.4.3.3. Pipetas graduadas en 0,1 mL de 1, 5 y 10 mL.
B.4.3.4. Embudos de filtración, tallo corto,
de
B.4.3.5. Matraces volumétricos de diferentes
capacidades.
B.4.3.6. Papel filtro Whatman No. 42 o No. 2
o su equivalente.
B.4.3.7. Perilla de succión
B.4.3.8. Material común de laboratorio.
B.4.4.
Reactivos.
Los reactivos que a continuación se mencionan
deben ser grado analítico y libres de fenol a menos que se indique otra
especificación y por agua debe entenderse agua destilada.
B.4.41. Hidróxido de bario
octahidratado [Ba(OH)2 . 8 H2O ].
B.4.4.2. Acido bórico (H3BO3).
B.4.4.3. Metaborato de sodio (NaBO2).
B.4.4.4. Cloruro de sodio (NaCl).
B.4.4.5. Borato de sodio
decahidratado (Na2 B4O7 . 10 H2O).
B.4.4.6.
Fenilfosfato disódico (Na2C6H5PO4)2H2O.
Cristales libres de fenol. Conservar en congelación o en desecador.
B.4.4.7. Alcohol butílico (C4H10O). Punto de ebullición 116-
B.4.4.8. Sulfato de zinc
heptahidratado (Zn SO4 7 H2O).
B.4.4.9. Sulfato de cobre
pentahidratado (CuSO4 5 H2O).
B.4.4.10. 2,6 Dibromoquinonacloroimida (BQC) C6H2OBr2NCl.
B.4.4.11. Fenol (C6H6O).
B.4.4.12. Solución
reguladora de hidróxido de bario-borato (pH 10,6 ±
Disolver en agua caliente
Cuando se aplique para leche, fórmula láctea
y producto lácteo combinado, pasteurizados descremados, sin sabor, diluir 500
mL de este regulador con 500 mL de agua.
Cuando se aplique para leche, fórmula láctea
y producto lácteo combinado, pasteurizados con sabor, diluir esta solución
reguladora con un cuarto de su volumen de agua (ejemplo 80 mL de este regulador
con 20 mL de agua).
Para leche de cabra esta solución reguladora
se prepara pesando
B.4.4.13.
Soluciones reguladoras de trabajo con fenil fosfato disódico.
B.4.4.13.1.
Para leche, fórmula láctea y producto lácteo combinado pasteurizados.
Disolver
Disolver
Diluir 1 mL de la solución acuosa a 100 mL
con el regulador de substrato (B.4.4.12). Calentar la solución a
B.4.4.13.2.
Para productos con sabor.
Disolver
B.4.4.13.3.Para
helados y sorbetes.
Disolver
B.4.4.13.4. Para
sorbetes.
Disolver
B.4.4.13.5. Para
quesos y cremas pasteurizadas.
Disolver
B.4.4.13.6.
Para mantequillas.
Disolver
B.4.4.14.
Solución reguladora para desarrollo de color (pH 9,8 ±
Disolver
B.4.4.15.
Solución reguladora para dilución de color. (Para el caso que la muestra haya
salido fuertemente positiva).
Diluir 100 mL de la solución anterior (B.4.4.14) a un litro con agua.
B.4.4.16.
Solución reguladora patrón para calibrar el potenciómetro (
Disolver
Para evitar contaminación con CO2 mantener perfectamente tapado el recipiente
o protegerlo con un tubo de cal sodada.
Esta solución reguladora debe utilizarse
dentro de los 10 min siguientes a su extracción del frasco.
B.4.4.17.
Reactivo precipitante de proteínas zinc-cobre.
B.4.4.17.1.
Para leche, fórmula láctea o producto lácteo combinado pasteurizados sin sabor
y sorbetes.
Disolver
B.4.4.17.2.
Para leche, fórmula láctea o producto lácteo combinado, pasteurizados con
sabor, helados y sorbetes.
Disolver
B.4.4.17.3.
Para quesos
Disolver
B.4.4.17.4.
Para crema pasteurizada.
Disolver
B.4.4.17.5.
Para mantequillas.
Disolver
B.4.4.18.
Solución de 2,6-dibromoquinonacloroimida (B.Q.C.) (C6H2OBr2NCl).
Disolver 40 mg de polvo de BQC en 10 mL de
alcohol etílico y conservar esta solución en frasco gotero ámbar. Guardar en
refrigeración. La solución es estable durante una semana. Desechar si se torna
color café.
Antes de usarse los nuevos frascos de BQC
deberán ser comprobados preparando curvas patrón con fenol y comparados con los
de la solución en buen estado; hacer esta comprobación cuando menos dos veces
por año.
B.4.4.19.
Solución de sulfato de cobre para patrones al 0,05%.
Disolver
B.4.4.20.
Solución de alcohol butílico.
Para ajustar su pH, mezclar un litro de éste,
con 50 mL de la solución reguladora para desarrollo de color (B.4.4.15). Conservar
en frasco de tapón de vidrio esmerilado.
B.4.4.21.
Solución madre de fenol de 1 mg/mL.
Pesar exactamente
B.4.4.22.
Solución patrón de fenol de 10 g/mL o 10 unidades/mL (solución
de trabajo).
Diluir 10 mL de la solución madre (B.4.4.21)
a un litro con agua y mezclar perfectamente.
Para preparar soluciones patrón más diluidas,
diluir 5, 10, 30 y 50 mL de esta solución en 100 mL para que respectivamente
contengan 0,5; 1,0; 3,0 y 5,0 g o unidades de fenol por mL. Estas soluciones patrón mantenidas en
refrigeración no se deben emplear después de una semana.
De manera semejante preparar las soluciones
patrón que contengan 20, 30 y 40 unidades por mL. Guardar en refrigeración y
permitir que esté a la temperatura ambiente en el momento de su uso.
B.4.4.23.
Solución reguladora de borato-hidróxido de bario (18:8 m/v). únicamente para
mantequillas.
Disolver en agua caliente
B.4.4.24.
Solución reguladora de sustrato (para valorar la pasteurización).
Disolver
Disolver
Diluir 1 mL de la solución acuosa a 100 mL
con el regulador de sustrato (B.4.4.12.). Calentar la solución a
B.4.5.
Procedimiento
B.4.5.1.
Preparación de la curva patrón de comparación.
B.4.5.1.1. En series de tubos (de preferencia graduados
en 5 y 10 mL), medir volúmenes adecuados de la solución patrón de trabajo, a
fin de obtener un margen favorable de patrones según las necesidades. Se
recomienda incluir 0,0 (testigo), 0,5; 5,0; 1,0; 3,0; 10,0; 20,0; 30,0 y 40,0
unidades.
B.4.5.1.2. Con objeto de aumentar la intensidad del
color azul y la estabilidad de los patrones agregar a cada tubo 1 mL de la
solución de sulfato de cobre al 0,05% (4.4.19) y a continuación 5 mL de la
solución reguladora para dilución de color (B.4.4.15). Llevar a un volumen de
10 mL con agua. Agregar 4 gotas de la solución B.Q.C. (B.4.4.18.) mezclar y
dejar en reposo 30 min, a temperatura ambiente para desarrollo de color.
B.4.5.1.3. En caso de emplear el procedimiento de
extracción con alcohol butílico normal, proceder como se indica más adelante.
B.4.5.1.4. Hacer la lectura de la intensidad del color
con un espectrofotómetro a 610 nanómetros, restar el valor que alcanza la
lectura del testigo a la de cada una de las soluciones patrones de fenol;
finalmente construir una curva de calibración la cual debe ajustarse mediante
el método de mínimos cuadrados (regresión lineal).
B.4.5.1.5.
.Si se pretende efectuar una
comparación visual de los patrones, se conservan en refrigeración y se prepara
una nueva serie cada semana.
B.4.5.1.6. Para el caso de la determinación de
fosfatasa en leche, fórmula láctea o producto lácteo combinado, es fundamental
la homogenización antes de desarrollar la técnica. Colocar varios mililitros en
un tubo de ensaye pequeño, tapar y guardar en el refrigerador; si es necesario
el empleo de un conservador agregar cloroformo en concentraciones de 1-3 mL por
cada 100 mL de leche, fórmula láctea o producto lácteo combinado.
B.4.5.2.
Preparación de
B.4.5.2.1.
Leche fórmula láctea o producto lácteo combinado.
B.4.5.2.1.1. Medir con pipeta 1 mL de muestra preparada
de leche en 2 o 3 tubos (se necesita un tubo como testigo y se recomienda
preparar dos o más tubos para determinaciones por duplicado); en caso de la
leche de cabra emplear 3,0 mL de la muestra.
B.4.5.2.1.2. Agregar a cada tubo 10 mL de la solución
reguladora de trabajo con fenil fosfato disódico (B.4.4.13.1.) o para las
determinaciones cuantitativas en leche cruda; tapar los tubos y mezclar (pH
10,0 ± 0,15).
B.4.5.2.1.3. Calentar el tubo testigo en un baño de agua
a ebullición cubierto durante 1 min (la temperatura interna del tubo debe estar
entre 85-
B.4.5.2.2.
Productos saborizados, helados y sorbetes.
B.4.5.2.2.1. Pesar
B.4.5.2.2.2. Calentar el tubo testigo en un baño de agua
a ebullición cubierto durante 1 min (la temperatura interna del tubo debe estar
entre 85-
B.4.5.2.2.3. Agregar a los tubos con muestra 1 mL de la
solución reguladora de trabajo correspondiente (B.4.4.13.), mezclar con el
agitador de vidrio. A partir de esta etapa manejar de igual forma el testigo y
las muestras.
B.4.5.2.2.4. Agregar 10 mL de la solución reguladora
correspondiente:
Para productos saborizados (B.4.4.13.2).
Para helados y sorbetes (B.4.4.13.3).
Para sorbetes (B.4.4.13.4).
B.4.5.2.3.
Mantequilla.
B.4.5.2.3.1. Pesar
B.4.5.2.3.2. Calentar el tubo con la muestra testigo en
un baño de agua a ebullición y cubierto, durante un minuto (la temperatura
interna del tubo debe estar entre 85 y
Agregar a cada tubo 10 mL de la solución
reguladora de trabajo (B.4.4.13.6), tapar los tubos y mezclar.
B.4.5.2.4.
Quesos y crema pasteurizada.
B.4.5.2.4.1. Pesar
B.4.5.2.4.2. Agregar al tubo que contiene la muestra
testigo 1 mL de solución reguladora de borato-hidróxido de bario. Calentar en
un baño a ebullición y cubierto, durante un minuto.
B.4.5.2.4.3.
Agregar a los tubos con
muestra, 10 mL de la solución reguladora de trabajo correspondiente
(B.4.4.13.7), mezclar con el agitador de vidrio. A partir de esta etapa manejar
de igual forma que el testigo y las muestras (excepto para crema vieja o
ligeramente agria en donde se agregan 7 mL de la solución reguladora de trabajo
y 2 mL de agua) para hacer un volumen total de 10 mL.
B.4.5.2.4.4. Mezclar (el agitador de vidrio puede
quedarse durante la incubación o retirarse en este paso). Si se retira,
enrollar una pieza de 2,5 x
Nota: La temperatura interna del tubo que contiene
la muestra testigo que debe estar entre 85-
B.4.5.3.
Determinación de Fosfatasa Residual (Esta parte del procedimiento es común a todos los derivados lácteos).
B.4.5.3.1. Inmediatamente después de agregar la
solución de substrato, incubar los tubos en baño de agua durante una hora a 37-
B.4.5.3.2. Agregar con una pipeta 1 mL de la solución
precipitante de proteínas zinc-cobre correspondiente (B.4.4.17) a los tubos de
la siguiente manera:
a) Para leche, fórmula láctea o producto lácteo
combinado, sin sabor y sorbetes
adicionar la solución (B.4.4.17.1).
b) Para leche, fórmula láctea o producto lácteo
combinado, pasteurizados con sabor, helados y sorbetes, adicionar la solución
(B.4.4.17.2).
c) Para quesos adicionar la solución
(B.4.4.17.3).
d) Para cremas adicionar la solución
(B.4.4.17.4).
e) Para mantequillas adicionar la solución
(B.4.4.17.5).
B.4.5.3.3. Mezclar perfectamente el contenido de los
tubos. El pH de la mezcla debe estar entre 9,0-9,1; filtrar (empleando embudos
de
B.4.5.3.4. Agregar 5 mL de solución reguladora para
desarrollo de color (B.4.4.14). El pH de la mezcla debe estar entre 9,3-9,4.
B.4.5.3.5 Agregar 4 gotas del reactivo B.Q.C.
(B.4.4.18), mezclar y dejar a temperatura ambiente durante 30 min para
desarrollo de color. En los casos en que se investigue pasteurización
deficiente se agregan 2 gotas del reactivo de B.Q.C.
B.4.5.3.6.
Determinar
a)
Método espectrofotométrico.
Leer las intensidades de color del tubo
testigo y de las muestras a 610 nm, restar la lectura del testigo de la lectura
del tubo de la muestra y convertir el resultado a unidades de fenol, utilizando
la curva patrón (B.4.5.1).
Ordinariamente se hace innecesaria la
extracción con alcohol butílico cuando se emplea el espectrofotómetro. En los
casos en que se emplee la extracción con este alcohol, purificar el reactivo
como se señala en la valoración de la pasteurización (B.4.4.13.1), centrifugar
la muestra durante 5 min a fin de romper la emulsión y remover el agua suspendida
en la capa alcohólica. Después de centrifugar, con una pipeta capilar provista
de bulbo de hule, separar todo el alcohol butílico. Filtrar y recoger el
filtrado en la celda del espectrofotómetro y leer a 610 nm.
b)
Método visual con escala de patrones.
Comparar los colores de las muestras que dan
más de 5 unidades con los tubos de color que contienen patrones de fenol
(B.4.5.1).
Para obtener resultados cuantitativos en
aquellos casos en que haya variaciones entre 0,5 y 5 unidades de color, hacer
la extracción con alcohol butílico, agregando 5 mL de alcohol e invirtiendo
lentamente varias veces; centrifugar como se señala en el método anterior, si
fuera necesario, para aumentar la claridad de la capa alcohólica y comparar el
color con los patrones tratados en igual forma.
En aquellas pruebas en las que durante el
desarrollo de color se obtengan resultados fuertemente positivos (por ejemplo
con 20 unidades o más) y en las cuales no sean suficientes 4 gotas del reactivo
de B.Q.C. (B.4.4.18) para reaccionar con todo el fenol, hacer diluciones
colocando nuevos tubos con volúmenes conocidos que se diluyen a 10 mL con la
solución reguladora de dilución de color (B.4.4.15) y agregar 2 o más gotas del
reactivo B.Q.C. En cada una de estas pruebas diluir el testigo y tratarlo
directamente.
De la misma manera en aquellos casos en los
que estas nuevas diluciones produzcan nuevamente reacciones fuertemente
positivas, todavía será necesario volver a preparar otras diluciones más, hasta
que el color quede comprendido entre los de la escala o de la curva del
espectrofotómetro.
Para hacer la lectura final, dejar
transcurrir 30 min a partir del momento de la adición del reactivo B.Q.C a fin
de que se desarrolle totalmente su color. Multiplicar las lecturas de las
diluciones por el factor de dilución por 2 en el caso de haber diluido 5 mL;
por 10, para aquella dilución inicial 1+9 mL y por 50, en caso de una dilución
inicial 1+9 mL, seguida de otra de 2+ 8 mL.
B.4.6.
Cálculos.
B.4.6.1.
Para leche, fórmula láctea o producto lácteo combinado, pasteurizados u otros
productos lácteos donde se
mide 1 mL de muestra líquida y se adicionan 11 mL de los reactivos (el volumen
total del líquido es de 12 mL) y se emplean 5 mL del filtrado.
U. de Fenol/mL = C x 2,4
B.4.6.2.
Para productos saborizados, helados y sorbetes donde se pesan
U. de Fenol/g = C x 2,2
donde:
C = concentración de la muestra obtenida de
la gráfica de la curva patrón en unidades fenol/mL.
2,2 y 2,4 = Factores de dilución.
B.4.6.3.
Para mantequilla y crema
donde se pesa
U. de Fenol/ g = C x 2.4
B.4.6.4.
Para queso donde se pesa
U. de Fenol/g = C x 4,4
donde:
C = concentración de la muestra obtenida de
la gráfica de la curva patrón en unidades fenol/mL.
2.2. y 4.4.= Factores de dilución con
respecto a los diferentes productos.
B.4.7.
Expresión de resultados.
|
Unidades de fenol / mL o g. |
B.5.
Determinación de Materia Extraña en leche, fórmula láctea, producto lácteo
combinado, dulces de leche, helados, mantequilla y cremas.
B.5.1.
Principio del método.
Los insectos enteros, fragmentos de los
mismos, pelos de roedor o alguna materia extraña se separan de la muestra por
filtración para su identificación al microscopio.
B.5.2.
Equipo
B.5.2.1. Balanza analítica con 0,1 mg de
sensibilidad.
B.5.2.2. Equipo de filtración al vacío.
B.5.2.3. Microscopio binocular estereoscopio
con objetivos que pueden ser de 3, 6, 7 y 10 X, oculares apareados de amplio
campo visual de 10, 30 y 100 X, respectivamente.
B.5.2.4. Lámpara para el microscopio o luz
natural equivalente.
B.5.3.
Materiales.
B.5.3.1. Embudo Büchner.
B.5.3.2. Matraz Kitazato.
B.5.3.3. Vasos de precipitados de 1000 mL
B.5.3.4. Caja Petri.
B.5.3.5. Papel de filtración rápida para
conteo con líneas paralelas de aproximadamente
B.5.3.6. Material común de laboratorio.
B.5.4.
Reactivos.
Los reactivos que a continuación se mencionan
deben ser grado analítico a menos que se indique otra especificación y por agua
debe entenderse agua destilada.
B.5.4.1. Mezcla de glicerina:etanol 1:3 (v/v)
(opcional).
B.5.5.
Procedimiento.
B.5.5.1.
Preparación de la muestra.
B.5.5.1.1.
Productos líquidos.
Mezclar bien todo el contenido de la muestra.
B.5.5.1.2.
Productos deshidratados.
Pesar por duplicado
B.5.5.2.
Determinación.
B.5.5.2.1.
Filtrar toda la muestra
sobre un embudo de succión preparado con papel filtro para conteo, tratando de
vertirlo uniformemente.
B.5.5.2.2.
Durante la filtración lavar
continuamente el papel filtro con agua a
B.5.5.2.3.
Pasar el papel filtro a una
caja Petri y humedecerla con la mezcla glicerina-etanol (opcional). Examinar al
microscopio utilizando una luz suficientemente fuerte que muestre los detalles
en el papel filtro.
B.5.5.2.4.
Contar con una aguja de
disección sobre toda la superficie del papel, línea por línea y explorar cada
pieza del material dado que algunos fragmentos son irreconocibles a menos que
se muevan.
B.5.6 Expresión de resultados.
B.5.6.1. Productos
deshidratados.
|
Presencia
o ausencia de insectos enteros, fragmentos de insectos, pelos de roedor y
cualquier materia extraña que se encuentre en |
B.5.6.2. Productos
líquidos.
|
Presencia
o ausencia de insectos enteros, fragmentos de insectos, pelos de roedor y
cualquier materia extraña que se encuentre en la cantidad de mL que contenga
el envase analizado. |
B.6. Determinación de materia
extraña en quesos. Método de filtración.
B.6.1. Principio del método.
La materia extraña debe separarse por
sedimentación y posteriormente filtrarse para su observación al microscopio.
B.6.2. Equipo
B.6.2.1. Parrilla de calentamiento con
agitación magnética.
B.6.2.2. Equipo de filtración al vacío.
B.6.2.3. Microscopio binocular estereoscópico
con objetivo que pueden ser de 3,6,7 y 10x y oculares apareados de amplio campo
visual de 10, 30 y 100 x respectivamente.
B.6.3. Materiales
B.6.3.1. Cuchillo
B.6.3.2. Vaso de precipitados de
B.6.3.3. Termómetro graduado de
B.6.3.4. Embudo Buchner
B.6.3.5. Matraz Kitasato de
B.6.3.6. Papel filtro Whatman # 1 de diámetro
igual al tamaño del embudo
B.6.3.7 Barra magnética
B.6.3.8. Material común de laboratorio
B.6.4.
Reactivos.
Todos los reactivos deben ser grado analítico
a menos que se indique otra especificación y por agua se entiende agua
destilada.
B.6.4.1.
Acido fosfórico 1:40 (H3PO4).
Mezclar un volumen de ácido fosfórico en 40
volúmenes de agua.
B.6.4..2.
Solución de hidróxido de sodio al 5% (Na OH).
Disolver
B.6.4.2.
Etanol (C2H5O)
B.6.5.
Procedimiento.
B.6.5.1. Cortar
B.6.5.2.
Filtrar sin permitir que la
muestra se acumule en el papel y para evitar que el filtro se obstruya lavar
continuamente con porciones de agua casi a ebullición. En caso de obstrucción
agregar al agua de lavado, una solución alcalina diluida (Hidróxido de sodio al
5% o ácido fosfórico 1:40 o alcohol caliente), hasta que el filtro quede
limpio, entonces adicionar la muestra en suspensión remanente en el vaso y
agua. Examinar el papel filtro al microscopio.
B.6.6.
Informe de
Presencia o ausencia de insectos enteros,
fragmentos de insectos, pelos de roedor, excretas o cualquier materia extraña
en
B.7.
Determinación de Arsénico, Plomo, Mercurio y Estaño.
B.7.1.
Fundamento
El método de absorción atómica se basa en
hacer pasar un haz de luz monocromática de una frecuencia tal que puede ser
absorbido por el analito que se encuentra presente en forma de vapor atómico.
La medida de intensidad luminosa antes y después de su paso por el vapor
atómico permite determinar el por ciento de absorción.
La cantidad de absorción aumenta con la
concentración de átomos en el medio absorbente, es decir, la media de la
absorción aumenta con la concentración
del elemento de la muestra, ya sea que esté en su condición original o sujeta a
pretratamiento.
B.7.2.
Materiales
B.7.2.1.
Matraces Kjeldahl de 500 mL
y 800 mL.
B.7.2.2.
Sistema de reflujo con
refrigerante.
B.7.2.3.
Crisoles Vycor de
B.7.2.4.
Crisoles de platino de
B.7.2.5.
Matraces Erlenmeyer de
diferentes capacidades.
B.7.2.6.
Matraces volumétricos de
diferentes capacidades.
B.7.2.7.
Matraces redondos de fondo
plano de 50 mL.
B.7.2.8.
Bombas Parr.
B.7.2.9.
Micropipetas o pipetas de
Eppendorf de diferentes capacidades.
B.7.2.10. Puntas de plástico para micropipetas.
B.7.2.11.
Papel filtro Whatman No. 2.
B.7.2.12.
Perlas de ebullición.
B.7.2.13. Varillas de plástico.
B.7.2.14.
Tubos de ensayo graduados de
propilen o propileno de 15 mL.
B.7.2.15. Recipientes de propilen o propileno.
B.7.2.16. Embudos de filtración de diferentes
capacidades.
B.7.2.17. Material común de laboratorio.
B.7.2.18. Todo
el material utilizado debe someterse a lavado de acuerdo con las siguientes
instrucciones:
B.7.2.18.1. El jabón que se use debe ser de preferencia
neutro.
B.7.2.18.2. Enjuagar perfectamente con agua corriente.
B.7.2.18.3. Sumergir el material de vidrio o plástico en
un recipiente (de preferencia plástico) que contenga una solución de ácido
nítrico grado RA al 30 %.
B.7.2.18.4. Dejarlo tapado y reposando por un lapso de
24 horas.
B.7.2.18.5.
Quitar el exceso de ácido
nítrico con varios enjuagues (5 o 6 veces) con agua deionizada.
B.7.2.18.6. Dejar escurrir y secar.
B.7.2.18.7. Guardar en cuanto esté seco para evitar
contaminación por partículas en el aire.
B.7.3.
Equipo
B.7.3.1. Lámparas de cátodo hueco o de descarga sin
electrodos para determinar arsénico, cadmio, cobre, estaño, fierro, mercurio,
plomo y zinc.
B.7.3.2. Fuente de radiofrecuencia en caso de usar
lámparas de descarga.
B.7.3.3. Automuestreador y recirculador de agua.
B.7.3.4. Placa de calentamiento con regulador que
alcance una temperatura de
B.7.3.5. Horno de microondas.
B.7.3.6.
Autoclave que alcance 121 ±
B.7.3.7. Centrífuga de laboratorio capaz de mantener
1600 rpm.
B.7.3.8.
Espectrómetro de absorción
atómica equipado con los accesorios para flama, horno de grafito, generador de
hidruros o vapor frío, dependiendo del método a seguir.
B.7.3.9. Balanza analítica con sensibilidad de 0,1
mg.
B.7.3.10. Mufla capaz de mantener una temperatura de
550 ±
B.7.3.11. Horno de calentamiento (estufa) con
intervalo de temperatura de 120 ±
B.7.3.12.
Los instrumentos que a
continuación se indican deben estar calibrados y ajustados antes de su
operación.
B.7.4.
Reactivos
B.7.4.1. Soluciones estándares de referencia
certificadas de cada uno de los metales. Agua, debe ser destilada deionizada,
con un grado máximo de conductividad de 1 µmho/cm a
B.7.4.2. Acido nítrico (densidad específica 1,41),
grado suprapuro o de alta pureza para el análisis de metales o equivalente
B.7.4.3. Acido nítrico (densidad específica 1,41),
contenido de mercurio muy bajo.
B.7.4.4.
Acido perclórico (densidad
específica 1,67), grado suprapuro, o de alta pureza para el análisis de metales
o equivalente
B.7.4.5.
Acido clorhídrico (densidad
específica 1,19), grado suprapuro, o de alta pureza para el análisis de metales
o equivalente
B.7.4.6. Acido sulfúrico (densidad específica 1,84), grado
suprapuro, o de alta pureza para el análisis de metales o equivalente
B.7.4.7 Acido sulfúrico 1 N a partir de la solución
grado suprapuro, o de alta pureza para el análisis de metales o equivalente
B.7.4.8 Acido nítrico 65% v/v grado RA.
B.7.4.9 Peróxido de hidrógeno (densidad específica
1,12).
B.7.4.10 Hidróxido de sodio granalla reactivo RA.
B.7.4.11 Aire comprimido seco y limpio.
B.7.4.12 Gases: acetileno, óxido nitroso, argón y
nitrógeno, grado absorción atómica.
B.7.4.13 Solución de Nitrato de Magnesio
hexahidratado al 7% p/v. Disolver
B.7.4.14 Acido clorhídrico 1 N. Diluir 8,3 mL de HCl
y llevar a 100 mL de agua.
B.7.4.15 Acido nítrico al 50% v/v. Diluir 50 mL de
HNO3 al 65% v/v grado
suprapuro en 50 mL de agua.
B.7.4.16 Acido clorhídrico
B.7.4.17 Acido clorhídrico 0,5 N. Diluir 4,15 mL de
HCl y llevar a 100 mL con agua.
B.7.4.18 Solución de Yoduro de Potasio al 15% p/v.
Disolver
B.7.4.19 Solución de Yoduro de Potasio al 20% p/v.
Disolver
B.7.4.20 Solución de Cloruro de Potasio (10 mg/mL de
K). Disolver
B.7.4.21 Solución de Nitrato de Magnesio al 50% p/v.
Disolver
B.7.4.22 Solución de ácido clorhídrico al 1,5% p/v.
Diluir 1,5 mL de HCl en 100 mL de agua destilada deionizada.
B.7.4.23 Solución de hidróxido de sodio al 1% p/v.
Pesar
B.7.4.24 Solución de borohidruro de sodio al 4% p/v
en solución de hidróxido de sodio al 1% p/v. Pesar
B.7.4.25 Solución reductora para mercurio. Mezclar 50
mL de ácido sulfúrico concentrado con aproximadamente 300 mL de agua. Enfriar a
temperatura ambiente y disolver
B.7.4.26 Solución de dilución para mercurio. En un
matraz de
B.7.4.27 Solución de trabajo de As de 1 µg/mL. Diluir
1 mL de la solución patrón de 1000 µg/mL a 1l con ácido sulfúrico 1N preparada
a partir de la solución grado suprapuro. Preparar fresca cada día.
B.7.5
Preparación de
B.7.5.1
Digestión por Vía Húmeda para la determinación de Pb.
B.7.5.1.1 Pesar con precisión de ± 0,1 mg, una
cantidad apropiada de muestra.
Para la determinación por el método de
absorción por flama pesar como máximo
B.7.5.1.2 Añadir 10 mL de ácido nítrico concentrado y
dejar reposar toda la noche o iniciar directamente la digestión.
B.7.5.1.3 Usar matraz de Kjeldhal o matraz conectado
al sistema de refrigerantes.
B.7.5.1.4
Calentar suavemente.
B.7.5.1.5 Digerir la muestra 3 horas o más tiempo si
es necesario (algunas muestras requieren la adición de mayor cantidad de ácido
nítrico) hasta la aparición del color traslúcido, si queda ámbar, adicionar peróxido
de hidrógeno gota a gota con agitación continua (reacción exotérmica).
B.7.5.1.6 Enfriar.
B.7.5.1.7 Recuperar, filtrar y llevar a un volumen
conocido en matraz volumétrico. Se pueden hacer tantas diluciones sean
necesarias de acuerdo a la cantidad contenido del metal.
B.7.5.1.8. Correr un blanco de reactivos y muestra
fortificada por cada serie de digestión.
B.7.5.1.9 Leer en el aparato de elección
(espectrómetro de absorción atómica por flama u horno de grafito).
B.7.5.2
Digestión por Vía Seca para la determinación de Pb.
B.7.5.2.1 Pesar con precisión de ± 0,1 mg, una
cantidad apropiada de muestra.
B.7.5.2.2 Para la determinación por el método de
absorción por flama pesar como máximo
B.7.5.2.3 Añadir 10 mL de ácido nítrico concentrado y
dejar reposar toda la noche o iniciar directamente la digestión. En productos
con alta concentración de proteínas adicionar una solución de nitrato de
magnesio al 7,0% p/v y mezclar completamente, llevar a sequedad aproximadamente
durante 6 horas en estufa a una temperatura de
B.7.5.2.4 Colocar la muestra en una mufla y elevar la
temperatura lentamente de
B.7.5.2.5 Elevar gradualmente la temperatura de
B.7.5.2.6 Apagar la mufla y dejar enfriar.
B.7.5.2.7
Un segundo paso de
calcinación puede ser requerido para remover algunos residuos de carbón,
mediante el siguiente procedimiento: Lavar las paredes del crisol con 2 mL de
ácido nítrico al 50%. Colocar la muestra en una placa de calentamiento puesta a
B.7.5.2.8
Disolver las cenizas
completamente en 5 mL de ácido clorhídrico 1N, transferir la muestra disuelta a
un tubo de propileno o a un matraz de volumen conocido, enjuagar el crisol con
dos alícuotas de 5 mL de ácido clorhídrico 1 N y transferir al mismo tubo o
matraz para obtener un volumen de 15 mL en el primero y llevar al aforo en el
segundo, tapar y mezclar, si existe presencia de partículas o materia
insoluble, filtrar en papel Whatman No. 2, antes de la determinación. Se pueden
hacer tantas diluciones sean necesarias de acuerdo a la cantidad contenido del
metal.
B.7.5.2.9
Correr un blanco de
reactivos y muestra fortificada por cada serie de digestión.
B.7.5.2.10 Leer en el aparato de elección
(espectrómetro de absorción atómica: flama u horno de grafito).
B.7.5.3
Digestión por Vía Húmeda para la determinación de Sn
B.7.5.3.1
Proceder igual que en el
punto B.7.5.1.1.
B.7.5.3.2 No adicionar ácido nítrico si no se lleva
cabo la digestión total en el mismo día.
B.7.5.3.3 Adicionar 30 mL de ácido nítrico concentrado
al matraz y calentar suavemente por 15 minutos en campana para iniciar la
digestión, evitando una excesiva producción de espuma.
B.7.5.3.4 Hervir suavemente hasta tener un remanente
de
B.7.5.3.5 Retirar la muestra del calor.
B.7.5.3.6 Al mismo tiempo correr dos blancos de
reactivos.
B.7.5.3.7 Adicionar 25 mL de ácido clorhídrico
concentrado, calentar suavemente durante aproximadamente 15 minutos, hasta que
todo el cloro sea liberado. Aumentar la temperatura gradualmente hasta
ebullición.
B.7.5.3.8 Evaporar hasta obtener de
B.7.5.3.9 Adicionar aproximadamente 40 mL de agua.
B.7.5.3.10 Agitar y pasar a un matraz de 100 mL y
enjuagar con 10 mL de agua.
B.7.5.3.11 Cuando el ácido clorhídrico está presente en
la digestión, las muestras se pueden quedar toda la noche o por más tiempo.
B.7.5.3.12 Agregar 1 mL de solución de cloruro de
potasio en cada matraz.
B.7.5.3.13 Enfriar a temperatura ambiente.
B.7.5.3.14 Diluir con agua y agregar más agua para
compensar el volumen de grasa en el matraz.
B.7.5.3.15 Mezclar perfectamente y filtrar de
B.7.5.3.16 No filtrar los blancos. Tapar las botellas
durante el análisis. Las soluciones son estables por varios meses.
B.7.5.3.17 Correr un blanco de reactivos y muestra
fortificada por cada serie de digestión.
B.7.5.3.18 Leer en el aparato de elección
(espectrómetro de absorción atómica: flama u horno de grafito).
B.7.5.4
Digestión por Vía Húmeda para la determinación de Hg.
B.7.5.4.1
Sistema de Reflujo.
B.7.5.4.1.1 Pesar como máximo 40g de líquidos, 20g de
alimentos que contengan del 50 al 75% de agua y 10g de alimentos sólidos o
semisólidos. Limite el contenido de grasa o aceite a un máximo de 4g y el total
de la materia orgánica a 5g
B.7.5.4.1.2 Conectar el matraz al sistema de reflujo y
agregar poco a poco la cantidad necesaria de ácido nítrico concentrado y
calentar durante media hora o hasta que no se observen cambios en la digestión.
B.7.5.4.1.3 Dejar enfriar y agregar una mezcla de ácido
nítrico y ácido sulfúrico concentrados (1 + 1).
B.7.5.4.1.4 Calentar y agregar más ácido nítrico gota a
gota sobre las paredes del recipiente, hasta que el color obscuro de la
solución desaparezca.
B.7.5.4.1.5 Enfriar.
B.7.5.4.1.6 Si existe grasa o cera filtrar la solución.
Se pueden hacer tantas diluciones sean necesarias de acuerdo a la cantidad
contenido del metal.
B.7.5.4.1.7 Correr un blanco de reactivos y muestra
fortificada por cada serie de digestión.
B.7.5.4.1.8 Leer en el aparato de elección
(espectrómetro de absorción atómica de vapor frío).
B.7.5.4.2
Sistema Cerrado.
B.7.5.4.2.1 Pesar con precisión de ± 0,1 mg, la cantidad
apropiada de muestra, dependiendo el tipo de ésta, en el recipiente de
digestión.
B.7.5.4.2.2 Agregar la cantidad necesaria de ácido
nítrico concentrado.
B.7.5.4.2.3 Tapar y sellar perfectamente el recipiente
de digestión.
B.7.5.4.2.4 Si el recipiente de digestión es un matraz
Erlenmeyer, colocar éste en una autoclave a 15lb por 30 minutos. Si se utiliza
bomba Parr, calentar en parrilla controlando la temperatura a un máximo de
B.7.5.4.2.5 Enfriar a temperatura ambiente.
B.7.5.4.2.6 En caso de que la digestión no sea completa
adicionar peróxido de hidrógeno y repetir la digestión.
B.7.5.4.2.7 Filtrar en caso de que exista grasa o cera y
analizar el contenido de Hg.
B.7.5.4.2.8 Correr un blanco de reactivos y muestra
fortificada por cada serie de digestión.
B.7.5.4.2.9 Leer en el aparato de elección
(espectrómetro de absorción atómica de vapor frío).
B.7.5.5
Digestión por Vía Húmeda-Seca para la determinación de As.
B.7.5.5.1 Proceder como en el punto B.7.4.4.2 hasta
que la digestión sea completa y posteriormente continuar con los siguientes
pasos.
B.7.5.5.2 Con una pipeta tomar una alícuota de la
solución de muestra digerida y colocarla en un crisol Vycor
B.7.5.5.3 Añadir 1 mL de solución de nitrato de
magnesio al 7% p/v y calentar en una parrilla a temperatura baja, hasta sequedad.
B.7.5.5.4 Incrementar el calor de la placa a un máximo
de
B.7.5.5.5 Colocar el matraz en la mufla a
B.7.5.5.6 Enfriar y disolver el residuo en 2,0 mL de
ácido clorhídrico
B.7.5.5.7 Añadir 0,1 mL de yoduro de potasio al 20%
p/v para reducir el As(V) a As(III).
B.7.5.5.8 Dejar reposar por un tiempo mayor a 2
minutos y transferir a un matraz y llevar al aforo con agua.
B.7.5.5.9 Correr un blanco de reactivos y muestra
fortificada por cada serie de digestión.
B.7.5.5.10 Leer en el aparato de elección
(espectrómetro de absorción atómica con adaptación para horno de grafito o
generador de hidruros).
B.7.5.6 Digestión
por Vía Seca para la determinación de As.
B.7.5.6.1 Pesar como máximo 40g de líquidos, 20g de
alimentos que contengan del 50 al 75% de agua y 10g de alimentos sólidos o
semisólidos. Limite el contenido de grasa o aceite a un máximo de 4g y el total
de la materia orgánica a 5g
B.7.5.6.2 Añadir el volumen necesario de nitrato de
magnesio al 50% p/v.
B.7.5.6.3 Homogeneizar con una varilla limpia de
plástico extendiendo la mezcla en el crisol.
B.7.5.6.4 Colocar la muestra en una mufla subiendo
gradualmente la temperatura hasta
B.7.5.6.5 Enfriar a temperatura ambiente y humedecer
las cenizas con ácido nítrico al 50% v/v.
B.7.5.6.6 Calentar en parrilla hasta la eliminación
del ácido.
B.7.5.6.7 Llevar los crisoles a una mufla elevando
gradualmente la temperatura de
B.7.5.6.8 Transferir las cenizas del crisol a un
matraz aforado usando una porción de 10 mL de ácido clorhídrico 0,5 N.
B.7.5.6.9 Enjuagar los crisoles con 5 mL de agua
destilada y transferir al matraz, añadir 1 mL de solución de yoduro de potasio
al 15% y mezclar.
B.7.5.6.10 Dejar reposar durante 15 minutos y llevar al
aforo.
B.7.5.6.11 Correr un blanco de reactivos y muestra
fortificada por cada serie de digestión.
B.7.5.6.12 Leer en el aparato de elección
(espectrómetro de absorción atómica con adaptación para horno de grafito o
generador de hidruros).
B.7.5.7
Digestión para la determinación de As, Pb, Sn, y Hg por horno de microondas.
B.7.5.7.1 Pesar con precisión de ± 0,1 mg,
B.7.6
Procedimiento
B.7.6.1
Espectrometría de Absorción Atómica por Flama.
B.7.6.1.1 Calibración.
B.7.6.1.1.1 Es necesario comprobar que se tiene una
calibración inicial y periódica aceptable.
B.7.6.1.1.2 Se inicia la configuración operacional del
instrumento y en el sistema de adquisición de datos. Permitir un periodo no
menor a 30 minutos para el calentamiento de las lámparas de descarga sin
electrodos.
B.7.6.1.1.3 Se debe verificar la estabilidad del
instrumento mediante el análisis de una solución estándar 20 veces más
concentrada que el límite de detección del instrumento (LDI) para el analito,
leída un mínimo de cinco veces y calculando la desviación estándar resultante,
la cual debe ser menor al 5%.
B.7.6.1.1.4 El instrumento debe calibrarse para el
analito a determinar usando el blanco de calibración y los estándares de
calibración preparados a 3 o 4 niveles de concentración dentro del intervalo
dinámico de concentración del analito.
B.7.6.1.1.5 Ajustar el instrumento a 0 con el blanco de
calibración. Introducir los estándares de calibración del analito de menor a
mayor concentración y registrar al menos tres réplicas de la absorbancia de
cada uno.
B.7.6.1.1.6 Elaborar una curva de calibración graficando
absorbancia en función de la concentración. Lo anterior puede llevarse a cabo
en equipos que se programan directamente, en los cuales sólo es necesario
introducir los estándares y marcar su concentración teórica.
B.7.6.1.2
Operación del Instrumento.
B.7.6.1.2.1 El desempeño del instrumento se verifica
mediante el empleo de blancos de calibración, estándares de calibración y una
muestra de control de calidad (MCC).
B.7.6.1.2.2 Después de que se ha realizado la
calibración, se debe verificar que el instrumento trabaje adecuadamente para el
analito. Para ello se analiza una muestra de control de calidad. Si las
mediciones varían en ± 10% o más, al valor establecido para
B.7.6.1.2.3 Para verificar que el instrumento no
presenta deriva, por cada 10 análisis se debe analizar el blanco de
calibración. Si el valor verdadero del analito difiere ± 10% o más, el
instrumento debe recalibrarse. Si el error persiste debe identificarse el
problema y corregirse. Si la matriz de la muestra es responsable de la deriva o
afecta la respuesta del analito puede ser necesario trabajar por adiciones
estándar.
B.7.6.1.2.4 La demostración de la operatividad inicial
del instrumento se hace estableciendo los límites de detección del método (LDM)
para el analito y el intervalo de calibración lineal. Para determinar el LDM se
usa un blanco de reactivos fortificado con una concentración del analito equivalente
de
LDM= t x s
t = valor de la "T" de Student a un
intervalo de confianza de 99% y una desviación estándar estimada para n-1
grados de libertad. t = 3,14 para 7 réplicas.
s = desviación estándar de las réplicas del
análisis.
El intervalo lineal de calibración se
establece a partir de por lo menos 4 estándares de diferente concentración, uno
de los cuales debe estar próximo al límite superior del intervalo lineal.
B.7.6.1.3
Determinación.
B.7.6.1.3.1
Ajustar el instrumento de
absorción atómica en las condiciones adecuadas para la determinación del
analito de acuerdo a las indicaciones del manual del instrumento.
B.7.6.1.3.2 Introducir el blanco de reactivos y la
muestra a analizar y registrar los valores de absorbancia. Se debe analizar al
menos un blanco de reactivos con cada grupo de muestras. Los valores obtenidos
ponen de manifiesto la calidad de los reactivos usados y el grado de
contaminación del laboratorio.
B.7.6.1.3.3 En los equipos que pueden programarse, la
lectura obtenida da directamente la concentración del elemento en las unidades
de concentración utilizadas.
B.7.6.1.3.4 Se debe analizar al menos un blanco de
reactivos fortificado para cada grupo de muestras. Se calcula la exactitud como
el por ciento de recuperación (de acuerdo al apartado B.7.5.1.2.4).
B.7.6.1.3.5 Se debe fortificar al menos una muestra por
grupo o el 10% de ellas lo que resulte mayor. La concentración añadida debe ser
de aproximadamente 0,1 unidades de absorbancia.
B.7.6.1.3.6 Se debe calcular el por ciento de
recuperación para el analito, de acuerdo a:
CM
- C
R = -------------- x 100
CA
R = % recuperación
CM = Concentración de la muestra fortificada
C = Concentración de la muestra
CA = Concentración equivalente de analito
añadido a la muestra.
B.7.6.1.3.7 Si la recuperación del analito en la muestra
fortificada está fuera del intervalo previamente establecido y el blanco de
reactivos fortificado está correcto, puede existir un problema relacionado con
la matriz de la muestra. Los datos se deben verificar por el método de las
adiciones estándar.
B.7.6.2
Espectrometría de Absorción Atómica por Horno de Grafito.
B.7.6.2.1
Calibración.
B.7.6.2.1.1
Proceder de acuerdo a los
puntos B.7.5.1
B.7.6.2.1.2 Elaborar una curva de calibración graficando
área de pico o altura máxima contra concentración del analito.
B.7.6.2.1.3 La calibración mediante el uso de una
computadora o una calculadora basada en el ajuste sobre los datos de
concentración respuesta es aceptada.
Lo anterior puede llevarse a cabo en equipos
que se programan directamente, en los cuales sólo es necesario introducir los
estándares y marcar su concentración teórica.
B.7.6.2.2
Operación del Instrumento.
B.7.6.2.2.1
Proceder de acuerdo a
B.7.5.1
B.7.6.2.3
Determinación.
B.7.6.2.3.1 Ajustar el instrumento de absorción atómica
en las condiciones adecuadas para la determinación del analito, de acuerdo a
las recomendaciones del manual del instrumento.
El programa de temperaturas para el horno de
grafito puede variar dependiendo de la matriz de la muestra. En el caso de
existir interferencias no específicas (absorción molecular o dispersión de la
luz), se recomienda consultar la bibliografía existente en cuanto a los métodos
disponibles para eliminarlas, así como en el caso de interferencias de matriz.
B.7.6.3
Espectrometría de Absorción Atómica por Generador de Hidruros.
B.7.6.3.1
Calibración.
B.7.6.3.1.1 Proceder de acuerdo a los puntos B.7.5.1
B.7.6.3.1.2 A partir de la solución estándar de As de
1000 mg/l, preparar una solución de As de 1 mg/l en ácido clorhídrico de
concentración apropiada al método. Trazar una curva de calibración de
absorbancia (máximo de la altura de pico) en función de la concentración del
analito para un intervalo de concentración de
B.7.6.3.2
Operación del Instrumento.
B.7.6.3.2.1 Proceder de acuerdo a B.7.5.1
B.7.6.3.3
Determinación
B.7.6.3.3.1 Ajustar el instrumento de absorción atómica
en las condiciones adecuadas para la determinación de As: longitud de onda de
193,7 nm y lámpara de descarga sin electrodos. Colocar y ajustar la celda de
absorción de acuerdo al manual del fabricante. Ajustar el flujo de gas
(nitrógeno o argón).
B.7.6.3.3.2 Ajustar a 0 de absorbancia con el blanco de
calibración de ácido clorhídrico al 1,5% siguiendo las instrucciones del manual
del fabricante.
B.7.6.3.3.3 Optimizar con un estándar de calibración la
respuesta del instrumento al analito (por lo general, 10 mL de una solución de
5 µg/l de As da una absorbancia de 0,2), ajustando el tiempo de purga I, el
tiempo de reacción y el tiempo de purga II.
B.7.6.3.3.4 Tomar un volumen conocido de la muestra
dirigida y seguir el mismo procedimiento que con los estándares de calibración.
B.7.6.4
Espectrometría de Absorción Atómica por Vapor Frío.
B.7.6.4.1
Calibración.
B.7.6.4.1.1 Proceder de acuerdo a los puntos B.7.5.1
B.7.6.4.1.2 A partir de la solución de trabajo de 1
µg/mL preparar estándares de calibración que contengan 0, 0,2, 0,4, 0,6, 0,8 y
1,0 µg de Hg a frascos de reacción. A cada frasco agregar 100 mL de la solución
de dilución y 20 mL de la solución de reducción. Trazar la curva de calibración
de absorbancia (altura máxima de pico) en función de la concentración del
analito.
B.7.6.4.2
Operación del Instrumento.
B.7.6.4.2.1
Proceder de acuerdo a
B.7.5.1
B.7.6.4.3
Determinación.
B.7.6.4.3.1 Ajustar el instrumento de absorción atómica
en las condiciones adecuadas para la determinación de Hg: longitud de onda de
253,6 nm, slit 0,7 nm y lámpara de cátodo hueco. Colocar y ajustar la celda de
absorción de acuerdo al manual del fabricante. Ajustar el flujo de gas
(nitrógeno o argón).
B.7.6.4.3.2 Ajustar a 0 de absorbancia con el blanco de
calibración (solución de dilución y de reducción) siguiendo las instrucciones
del manual del fabricante.
B.7.6.4.3.3 Optimizar con un estándar de calibración la
respuesta del instrumento al analito.
B.7.6.4.3.4 Tomar 25 mL de la muestra digerida y seguir
el mismo procedimiento que con los estándares de calibración.
B.7.7
Expresión de Resultados
B.7.7.1.
Método de Cálculo.
Interpolar los valores de absorbancia o
altura de pico de la muestra analizada en la curva de calibración y obtener los
mg/kg del elemento en la muestra y realizar los cálculos empleando la siguiente
fórmula:
|
mg/ kg = |
A x B |
|
C |
en donde:
A = Concentración en mg/kg de la muestra a
interpolar en la curva de calibración.
B = Volumen final al que se llevó la muestra
(mL).
C = Peso de la muestra (g) o volumen de la
muestra (mL) en el caso de agua.
En los equipos que pueden programarse, la
lectura obtenida da directamente la concentración del elemento en mg/kg o
µg/kg.
B.7.8
Informe de
Los resultados se informarán en mg/kg o µg/kg
del elemento a determinar.
B.8.
Determinación de AFM1 en leche, fórmula láctea o producto lácteo
combinado por columna de inmunoafinidad- HPLC.
B.8.1
Principio del Método.
B.8.2 Equipo.
B.8.2.1 Sistema HPLC, que incluye:
B.8.2.2 Bomba
B.8.2.3 Inyector automático o manual de
muestras.
B.8.2.4 Columna HPLC C18 de 4.6 x
B.8.2.5 Detector de fluorescencia
B.8.2.6 Integrador de datos o computadora
personal con el software adecuado para el control del equipo y procesamiento de
datos
B.8.2.7 Bomba manual (cuerpo de jeringa de
vidrio de 50 mL unida a través de un conector de plástico a un suministro de
aire) o manifold para extracción por vacío en fase sólida.
B.8.2.8 Centrífuga a 2000 rpm.
B.8.2.9 Mezclador tipo vórtex.
B.8.2.10 Balanza analítica de lectura 0,1 mg.
B.8.211 Espectrofotómetro capaz de hacer
mediciones de
B.8.2.12 Equipo de filtración Millipore o
similar.
B.8.2.13 Sistema de evaporación de muestras
multipuesto en baño seco con bomba de vacío.
B.8.2.14 Extractor en fase sólida o Vaccum
manifold
B.8.2.15 Bomba de vacío
B.8.3.
Materiales
B.8.3.1 Columnas de inmunoafinidad. Se
sugiere adquirir columnas con una capacidad de carga de no menos de 100ng de AFM1.
B.8.3.2 Tubos de centrífuga.
B.8.3.3 Vasos de precipitados de 100 mL.
B.8.3.4 Pipetas volumétricas de 50 mL.
B.8.3.5 Pipetas graduadas de 10 mL.
B.8.3.6 Auxiliar de macropipeteado.
B.8.3.7 Jeringas de vidrio o desechables de
50 mL.
B.8.3.8 Micropipetas de
B.8.3.9 Puntas para micropipeta.
B.8.3.10 Filtros para solventes orgánicos de
B.8.3.11 Filtros para solventes acuosos de
B.8.3.12 Filtros para muestras de
politetrafluoretileno de
B.8.3.13 Matraces aforados color ámbar de 5,
25 y 100 mL.
B.8.3.14 Jeringas desechables de 5 mL sin
aguja.
B.8.3.15 Frascos vial color ámbar de 5 mL con
tapón.
B.8.3.16 Matraces Erlenmeyer de 250 mL.
B.8.3.17 Celdas de cuarzo para
espectofotómetro de
B.8.3.18 Pipetas Pasteur.
B.8.3.19 Papel filtro Whatman No. 4 o
equivalente.
B.8.3.20 Adaptadores o acoples de apilamiento
para unir columnas de inmunoafinidad (adaptors starcking 1,3 or 5 mL part Nª
5185-57-94 Agilent o similar)
B.8.3.21 Embudos
B.8.4
Reactivos.
Los reactivos que a continuación se mencionan
deben ser de grado analítico y por agua debe entenderse agua estilada.
B.8.4.1 Acetonitrilo ( C2H3N) grado HPLC.
B.8.4.2
2-Propanol (isopropanol)
grado HPLC.
B.8.4.3
Agua (H2O) destilada y grado HPLC.
B.8.4.4
Acido sulfúrico concentrado
(H2SO4).
B.8.4.5
Patrón certificado de 50 g AFM1 en película.
B.8.4.6
Tripsina (proteasa
pancreática), 2000 FIP-U/g.
B.8.4.7
Dicromato de potasio (K2Cr2O7).
B.8.4.8
Solución de ácido sulfúrico
0,018 N. Disolver 1 mL de ácido sulfúrico concentrado y aforar a
B.8.4.9
Soluciones patrón de
dicromato de potasio.
B.8.4.9.1
Aproximadamente
Pesar exactamente 78 mg de dicromato de
potasio previamente secado en estufa a 100-
B.8.4.9.2
Aproximadamente
Diluir 25 mL de la solución de
B.8.4.9.3
Aproximadamente
Diluir 25 mL de la solución de
B.8.4.10
Fase móvil para HPLC.
Agua-Acetonitrilo (75:25). Filtrar a través de filtro de membrana de 0,45 m y degasificar. Es recomendable si el sistema cuenta con una bomba
binaria o cualquier otra, no se realice la mezcla por medio de ésta, debido a
la facilidad con que se generan burbujas
B.8.4.11
Cloruro de sodio
B.8.4.12
Fosfato disódico dihidratado
B.8.4.13
Cloruro de potasio
B.8.4.14
Hidróxido de sodio
B.8.4.15
Solución salina
amortiguadora de fosfatos para lavado de columna de inmunoafinidad (pesar
B.8.5
Procedimiento.
B.8.5.1
Preparación de
B.8.5.1.1
Productos Líquidos.
Calentar las muestras de leche entre 35 -37ªC
en baño de agua termostaizada y a continuación homogenizar suavemente, con
barra magnética para dispersas la grasa. Centrifugar un volumen de muestra
(2000g-15 min) para separar la grasa y eliminar la capa superior. Filtrar la
porción restante del tubo con papel Whatman Nª 4 (o similar) y transferir 50 mL
cuantitativamente medidos al reservorio de la columna de inmunoafinidad, la
cual previamente, se encuentra a temperatura ambiente.
Para el análisis de productos esterilizados,
es recomendable diluir volumen a volumen con agua destilada previo
calentamiento y filtración o produco preparado. Para el análisis de productos
esterilizados, es recomendable diluir volumen a volumen con agua destilada
previo al calentamiento y filtración o centrifugación.
B.8.5.1.2
Productos Deshidratados.
Reconstituir con agua de acuerdo con las
instrucciones señaladas en la etiqueta o
Nota: Para el análisis de caseinatos de
sodio, calcio y potasio, es necesario efectuar una hidrólisis enzimática de la
porción de prueba previo a la filtración o centrifugación. Para este propósito,
proceder de igual forma que con los productos deshidratados, pero adicionando
B.8.5.2
Calibración del Espectrofotómetro:
B.8.5.2.1
Determinar la absorbancia
(A) de las tres soluciones de K2Cr2O7 0,25, 0,125 y
B.8.5.2.2
Calcular la absorbitividad
molar (e) de cada
concentración con la siguiente fórmula:
(e)= A
x 1000 Conc. (mM)
B.8.5.2.3
Si los tres valores varían,
revisar la técnica o el instrumento, promediar los 3 valores para obtener el
valor de (e).
B.8.5.2.4
Determinar el factor de
corrección (FC) para cada instrumento y celdas en particular, sustituyendo en
la siguiente ecuación:
FC= 3160
(e)
Donde: 3160 = Valor de (e) de las soluciones de K2Cr2O7
B.8.5.2.5
Si el valor de FC es <
0,95 o > 1,05 revisar el instrumento o técnicas, para determinar o eliminar
la causa (usar el mismo juego de celdas en la calibración y determinación de la
pureza).
B.8.5.3
Preparación de Soluciones Patrón de AFM1.
B.8.5.3.1
Solución Patrón de 2 ng/L.
B.8.5.3.1.1
Por medio de una jeringa,
introducir aproximadamente 2 mL de acetonitrilo dentro del vial sellado que
contiene el patrón certificado de AFM1. Agitar vigorosamente durante
1 minuto en mezclador tipo vórtex y transferir cuantitativamente a un matraz
volumétrico de 25 mL usando pequeñas porciones de acetonitrilo. Diluir al
volumen con acetonitrilo y mezclar bien.
B.8.5.3.1.2
Transferir una alícuota de
2-3 mL de esta solución a una celda de cuarzo y registrar el espectro
ultravioleta entre 330 y 370 nm, usando acetonitrilo en la celda de referencia.
Medir la absorbancia de la solución a la longitud de onda de máxima absorción
(la cual es cercana a 325 nm). Determinar la concentración exacta de esta
solución empleando la siguiente ecuación:
ng AFM1/L![]()
En donde:
A= absorbancia a 350 nm.
PM= Peso molecular para AFM1= 328.
= coeficiente de extinción para AFM1=
19,850.
FC= Factor de corrección (calculado en
B.9.5.2.4).
B.8.5.3.1.3
Regresar la solución de AFM1
al frasco original. Almacenar esta solución en el congelador por un
máximo de 2 años, pero verificar su concentración cada 6 meses. Antes de usar
esta solución permitir que alcance la temperatura ambiente. Debe mantenerse
lejos de la luz directa
B.8.5.3.2
Solución Patrón de 0,5 mg/mL.
Medir un volumen apropiado de solución patrón
(B.8.5.3.1.) en un matraz volumétrico de 5 mL, dado que se transfieran
exactamente 500 mg de AFM1.
Diluir al volumen con acetonitrilo y mezclar vigorosamente en vortex. Esta
solución es estable por 2 meses si es almacenada en refrigeración (
B.8.5.3.3
Soluciones Patrón de Trabajo.
Preparar una serie de soluciones estándares
calibrantes con el objeto de inyectar masas de aflatoxina M1 de 0,5, 1,0, 5,0 y
10 ng cada una presente en 50 mL de inyección AFM1. Para ello medir el volumen apropiado de
solución (B.8.5.3.2) en un vial color ámbar y evaporar, con flujo de nitrógeno.
Diluir al volumen necesario con fase móvil del inciso 8.4.10. Preparándose en
el día de su uso.
B.8.5.4
Extracción de
B.8.5.4.1
Firmemente conectar una
columna de inmunoafinidad a la punta de una jeringa de vidrio o desechable
utilizada como reservorio por medio de acoples y colocar en el extractor de
fase sólida (manifold de vacío).
B.8.5.4.2
Medir 50 mL de la muestra en
el depósito de la jeringa y pasarla a través de la columna de inmunoafinidad a
un flujo aproximado de 2-3 mL/min.
B.8.5.4.3
Lavar la columna con 20 mL
de buffer a un flujo aproximado de 2-3 mL/min. Descartar los lavados. Pasar de
2-3 mL de aire o suave flujo de nitrógeno para secar el material de empaque.
B.8.5.4.4
Eluir lentamente la
aflatoxina con 4mL de acetonitrilo. Dejar el acetonitrilo en contacto con la
columna por lo menos 3 minutos para asegurar la completa remoción de la toxina
ligada. Esto se logra reflujando el acetonitrilo de dos a tres veces. Colectar
el eluido en un vial de 5 mL.
B.8.5.4.5
Evaporar a sequedad a
B.8.5.5
Cuantificación por HPLC.
B.8.5.5.1
Encender todos los componentes
del sistema de cromatografía.
B.8.5.5.2
Fijar los siguientes
parámetros cromatográficos de acuerdo con las instrucciones de operación del
equipo:
|
Fase
móvil: |
Agua:Acetonitrilo
(B.8.4.10). |
|
Flujo: |
0,8
mL/min. |
|
Volumen
de inyección: |
50
L (equivalente a 12,5 mL de producto fluido o |
|
Detector
de fluorescencia |
Excitación: 365 nm. Emisión: 435 nm. |
B.8.5.5.3
Purgar las bombas del
sistema con cada uno de los componentes de la fase móvil.
B.8.5.5.4
Correr la fase móvil a
través de todo el sistema a un flujo de 0,8mL/min, hasta obtener una línea base
estable.
B.8.5.5.5
Inyectar 50 L de la solución de trabajo de AFM1 de la mayor concentración (B.8.5.3.2) y
ajustar los controles del detector de fluorescencia para dar al menos un 80% de
respuesta del registrador. Repetir las inyecciones 2-3 veces hasta que las
áreas del pico son constantes. La aflatoxina eluye en un tiempo aproximado de
11 minutos.
B.8.5.5.6
El día del análisis,
inyectar en secuencia, volúmenes de 50 L de cada solución patrón de trabajo y preparar una curva de
calibración graficando el área del pico contra la concentración de AFM1
inyectada. Ajustar la curva por método de mínimos cuadrados (Regresión Lineal).
B.8.5.5.7
Inyectar del mismo modo 50 L de cada una de las muestras y determinar la cantidad de AFM1
en la muestra utilizando la ecuación de la recta obtenida en la curva de
calibración como sigue:
Y = m x + b
En donde:
Y = Area del pico correspondiente a
m = pendiente.
x = concentración en ng/L de AFM1 en la muestra.
b = ordenada al origen.
Despejar x, para obtener los ng/L de AFM1 en la muestra.
X= concentración en ng de AFM1 en
la muestra.
Despejar X, para obtener los ng de AFM1
en la muestra
B.8.5.5.8
Si el área del pico obtenido
para la muestra es mayor que la obtenida para la solución patrón de la mayor
concentración, preparar una solución adecuada diluyendo con Fase móvil B.8.4.10
y volver a inyectar.
B.8.5.6
Determinación de
B.8.5.6.1
Realizar los cálculos
necesarios para la fortificación de una muestra por triplicado, con el punto medio
de la curva y prosiguiendo como describe B.8.5.4.2 a B.8.5.4.5.
B.8.5.6.2
Eluir
B.8.5.6.3
Inyectar 50 L al sistema HPLC bajo las condiciones descritas anteriormente. El lote
de columnas de inmunoafinidad es adecuado si la recuperación de AFM1
es > 80%.
B.8.6
Cálculos:
Calcular la concentración de AFM1
en la porción de prueba, usando las siguientes fórmulas:
ng AFM1 /mL = g AFM1 /L ![]()
ng AFM1 /mL = g AFM1 /L ![]()
Esta fórmula es aplicable sólo cuando ninguna
dilución ha sido efectuada. El factor de dilución correspondiente debe ser
tomado en cuenta (por ejemplo en el análisis de productos esterilizados o
cuando la muestra se sale del intervalo de la curva de calibración).
B.8.7
Expresión de Resultados.
|
g de AFM1 /L |
B.8.6
Preparación y Dilución de Muestras para su Análisis Microbiológico.
B.9.1
Fundamento
Se basa en la preparación de diluciones
primarias, para obtener una distribución lo más uniforme posible de los
microorganismos presentes en la porción de muestra.
B.9.2
Materiales y Equipo
B.9.2.1 Pipetas bacteriológicas para
distribuir 10 y 1 mL (o si es necesario de 1 mL y 2 mL), con tapón de algodón.
Las pipetas pueden ser graduadas en volúmenes iguales a una décima de su
volumen total.
B.9.2.2 Frascos de vidrio de 250 mL con tapón
de rosca.
B.9.2.3 Tubos de 16 x
B.9.2.4 Utensilios esterilizables para la
obtención de muestras: cuchillos, pinzas, tijeras, cucharas, espátulas, etc.
B.9.2.5 Todo el material e instrumentos que
tengan contacto con las muestras bajo estudio deberán esterilizarse mediante:
Horno, durante 2 h a
B.9.2.6 El material de vidrio puede
sustituirse por material desechable que cumpla con las especificaciones
deseadas. No debe usarse material de vidrio dañado por esterilización repetida
y éste debe ser químicamente inerte.
B.9.2.7 Horno para esterilizar que alcance
una temperatura mínima de
B.9.2.8 Autoclave con termómetro y manómetro,
calibrada con termómetro de máximas y mínimas.
B.9.2.9 Baño de agua con control de
temperatura y circulación mecánica, provista con termómetro calibrado con
divisiones de
B.9.2.10 Licuadora de una o dos velocidades
controladas por un reóstato o bien un homogeneizador peristáltico (Stomacher).
B.9.2.11 Vasos para licuadora con tapa
esterilizables o bolsas estériles para homogeneizador peristáltico.
B.9.2.12 Balanza granataria con sensibilidad
de
B.9.2.13 Vórtex para la agitación de las
diluciones.
B.9.2.14 Perilla.
B.9.2.15 Frascos de vidrio con capacidad de
B.9.3
Reactivos
Los reactivos que a continuación se mencionan
deben ser grado analítico. Cuando se indique agua debe entenderse como agua
destilada.
B.9.3.1
Solución de Hidróxido de Sodio 1,0 N
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Hidróxido de sodio |
|
|
Agua |
100 mL |
Preparación:
Disolver el hidróxido de sodio y llevar a 100
mL con agua.
B.9.3.2
Soluciones Diluyentes
B.9.3.2.1
Solución Reguladora de Fosfatos (solución concentrada).
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Fosfato de sodio monobásico |
|
|
Agua |
|
Preparación:
Disolver el fosfato en 500 mL de agua y
ajustar el pH a 7,2 con solución de hidróxido de sodio 1,0N. Llevar a un litro
con agua. Esterilizar durante 15 minutos a 121° ± 1,0°C. Conservar en
refrigeración (solución concentrada). Tomar 1,25 mL de la solución concentrada
y llevar a un litro con agua (solución de trabajo). Distribuir en porciones de
99, 90 y 9 mL según se requiera. Esterilizar a 121° ±
B.9.3.2.2
Agua Peptonada
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Peptona |
|
|
Cloruro de sodio |
|
|
Agua |
|
Preparación:
Disolver los componentes en un litro de agua.
Ajustar el pH a 7 ± 0,1 con hidróxido de sodio 1,0N. Distribuir en porciones de
99, 90 y 9 mL o en cualquier volumen múltiplo de nueve según se requiera.
Esterilizar a 121 ±
B.9.4
Procedimiento
B.9.4.1
Preparación de
B.9.4.1.1
A partir de muestras líquidas:
Para muestras líquidas no viscosas en las
cuales la distribución de microorganismos es homogénea o fácilmente
homogeneizable por medios mecánicos (agitación, etc.).
Para muestras congeladas de un alimento
originalmente líquido o licuable, fundir por completo en baño de agua de
Para la parte líquida de una muestra
heterogénea la cual sea considerada suficientemente representativa de la
muestra total (por ejemplo la fase acuosa de grasas animales y vegetales).
B.9.4.1.1.1
Agitar la muestra
manualmente con 25 movimientos de arriba a abajo en un arco de 30cm efectuados
en un tiempo de 7 segundos. Tomar 1 mL de la muestra y diluir con 9 mL del
diluyente el cual debe encontrarse a una temperatura similar a ésta, evitando
el contacto entre la pipeta y el diluyente. Considerar el uso de vórtex para la
agitación de los tubos.
B.9.4.1.1.2
Siempre que la cantidad de
muestra lo permita, tomar alícuotas mayores, por ejemplo volúmenes de 10 u 11
mL, diluidos con 90 o 99 mL, de la misma forma que se describió anteriormente.
B.9.4.1.2
A partir de muestras sólidas o semisólidas.
B.9.4.1.2.1
Las muestras sólidas y
semisólidas congeladas, deben descongelarse en refrigeración de
B.9.4.1.2.2
Pesar una cantidad de 10 u
B.9.4.1.2.3
Adicionar un volumen de
B.9.4.1.2.4
Operar la licuadora o el
homogeneizador peristáltico de
B.9.4.1.2.5
Permitir que las partículas
grandes se sedimenten, y transferir la cantidad deseada tomando de las capas
superiores de la suspensión. Cuando la dilución primaria es muy viscosa o
pegajosa, adicionar más diluyente, lo cual debe tomarse en cuenta para las
operaciones subsecuentes o expresión de resultados. El homogeneizador
peristáltico (Stomacher) puede no ser adecuado para algunos productos (por
ejemplo, aquellos con partículas agudas o constituyentes que no se dispersen
fácilmente). Debe ser utilizado sólo cuando exista evidencia (publicada o por
ensayos comparativos) de que los resultados obtenidos no difieren
significativamente con aquellos obtenidos con licuadora.
B.9.4.2
Preparación de las Diluciones Decimales Adicionales.
B.9.4.2.1 Transferir 1 mL o un múltiplo, por ejemplo, 10 u 11 mL de la dilución
primaria 1 + 9 (10-1), en otro recipiente conteniendo nueve veces el volumen
del diluyente estéril a la temperatura apropiada, evitando el contacto entre la
pipeta y el diluyente.
B.9.4.2.2
Mezclar cuidadosamente cada
botella de diluyente siempre de la misma manera que se describe en B.9.4.1.1.1.
B.9.4.2.3
La selección de las
diluciones que se vayan a preparar y de aquellas que se van a inocular,
dependen del número esperado de microorganismos en la muestra, con base a los
resultados de análisis previos y de la información que se obtenga del personal
de inspección que la haya colectado. En ausencia total de información, trabajar
con las diluciones de la primera a la sexta.
B.9.4.2.4
Utilizar pipetas diferentes
para cada dilución inoculando simultáneamente las cajas que se hayan
seleccionado. El volumen que se transfiera nunca debe ser menor al 10% de la
capacidad total de la pipeta.
B.9.4.2.5
Si la pipeta es terminal y
se transfiere un volumen de líquido equivalente a su capacidad total, escurrir
aplicando la punta de la pipeta una sola vez en un área de la caja Petri sin
líquido.
B.9.4.2.6
Mientras se afora el líquido
de la pipeta, la punta de ésta debe apoyarse en el interior del cuello del
frasco y mantenerla en posición vertical, para lo cual este último debe
inclinarse lo necesario.
En estudios donde se busca la presencia o
ausencia de una determinada especie de microorganismos en 0,1 mL o
El criterio para seleccionar las diluciones a
preparar de acuerdo con el número de microorganismos esperado es:
Para la técnica del número más probable
utilizar tres tubos: donde sea posible demostrar el microorganismo en 10 mL de
la dilución más alta.
Para la técnica de cuenta en placa,
considerar aquellas en las que se puedan contar de
B.9.4.3
Duración del Procedimiento.
En general, las diluciones de la muestra
deben ser preparadas inmediatamente antes del análisis y éstas deben ser usadas
para inocular el medio de cultivo dentro de los 20 minutos posteriores a su
preparación.
B.10
Método para
B.10.1 Fundamento
del método
El método permite determinar el número de
microorganismos coliformes presentes en una muestra, utilizando un medio
selectivo (agar rojo violeta bilis) en el que se desarrollan bacterias a
B.10.2 Materiales
B.10.2.1 Pipetas bacteriológicas para
distribuir 10 y 1 mL (o si es necesario de 11 y 2 mL), con tapón de algodón.
Las pipetas pueden ser graduadas en volúmenes iguales a una décima de su
volumen total.
B.10.2.2 Frascos de vidrio de 250 mL con
tapón de rosca.
B.10.2.3 Tubos de 16 X
B.10.2.4 Utensilios esterilizables para la
obtención de muestras: cuchillos, pinzas, tijeras, cucharas, espátulas, etc.
B.10.2.5 Cajas Petri.
B.10.2.6 Todo el material e instrumentos que
tengan contacto con las muestras bajo estudio debe esterilizarse mediante:
Horno, durante 2 h a 170 -
B.10.2.7 El material de vidrio puede
sustituirse por material desechable que cumpla con las especificaciones
deseadas. No debe usarse material de vidrio dañado por las esterilizaciones
repetidas y éste debe ser químicamente inerte.
B.10.3 Aparatos
e instrumentos
B.10.3.1 Horno para esterilizar que alcance
una temperatura mínima de
B.10.3.2 Autoclave con termómetro y
manómetro, calibrada con termómetro de máximas y mínimas.
B.10.3.3 Baño de agua con control de
temperatura y circulación mecánica, provista con termómetro calibrado con
divisiones de 0,1° C y que mantenga la temperatura a 45 ± 1,0°C.
B.10.3.4 Licuadora de una o dos velocidades
controladas por un reóstato o bien un homogeneizador peristáltico (Stomacher).
B.10.3.5 Vasos para licuadora con tapa
esterilizables o bolsas estériles para homogeneizador peristáltico.
B.10.3.6 Incubadora con termostato que evite
variaciones mayores de ± 1,0° C, provista con termómetro calibrado.
B.10.3.7 Contador de colonias de campo
oscuro, con luz adecuada, placa de cristal cuadriculada y lente amplificador.
B.10.3.8 Registrador mecánico o electrónico.
B.10.3.9 Microscopio óptico.
B.10.3.10 Potenciómetro con una escala mínima
de 0,1 unidades de pH a
B.10.4 Reactivos
Los reactivos que a continuación se
mencionan, deben ser grado analítico y cuando se indique agua debe entenderse
como agua destilada.
B.10.4.1 Soluciones
Diluyentes
B.10.4.1.1
Solución Reguladora de Fosfatos (solución concentrada)
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Fosfato monopotásico |
|
|
Agua |
|
Preparación:
Disolver el fosfato en 500 mL de agua y
ajustar el pH a 7,2 con solución de hidróxido de sodio 1,0N. Llevar con agua a
un litro. Esterilizar a 121±
Tomar 1,25 mL de la solución concentrada y
llevar a un litro con agua (solución de trabajo). Distribuir en porciones de
99, 90 y 9 mL según se requiera. Esterilizar durante 15 minutos a 121± 1,0°C.
Después de la esterilización, el pH y los volúmenes finales de la solución de
trabajo deben ser iguales a los iniciales.
B.10.4.1.2
Agua Peptonada
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Peptona |
|
|
NaCl |
|
|
Agua |
|
Preparación:
Disolver los componentes en un litro de agua.
Ajustar el pH a 7,0 con hidróxido de sodio 1,0 N. Distribuir en porciones de
99, 90 y 9 mL o en cualquier volumen múltiplo de nueve según se requiera.
Esterilizar durante 15 minutos a 121 ± 1,0°C. Después de la esterilización, los
volúmenes finales de la solución de trabajo deben ser iguales a los iniciales.
Si este diluyente no es usado inmediatamente,
almacenar en lugar obscuro a una temperatura entre
B.10.4.2
Medio de Cultivo Agar-rojo-violeta-bilis-lactosa (RVBA)
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Peptona |
|
|
Extracto de levadura |
|
|
Lactosa |
|
|
Sales biliares |
|
|
Cloruro de sodio |
|
|
Rojo neutro |
|
|
Cristal violeta |
|
|
Agar |
|
|
Agua |
|
Preparación:
Mezclar los componentes en el agua y dejar reposar
durante algunos minutos. Mezclar perfectamente y ajustar el pH a 7,4 con ácido
clorhídrico 0,1N o con hidróxido de sodio 0,1N a
B.10.5
Preparación de
La preparación de la muestra debe ser de
acuerdo a lo establecido en el numeral 9 de este apéndice normativo.
B.10.6
Procedimiento
B.10.6.1 Colocar en cajas Petri por duplicado 1 mL de
la muestra líquida directa o de la dilución primaria, utilizando para tal
propósito una pipeta estéril.
B.10.6.2 Repetir el procedimiento tantas veces como
diluciones decimales se requiera sembrar, utilizando una pipeta estéril
diferente para cada dilución.
B.10.6.3 Vertir de
B.10.6.4 Mezclar cuidadosamente el inóculo con el
medio con seis movimientos de derecha a izquierda, seis movimientos en el
sentido de las manecillas del reloj, seis movimientos en el sentido contrario
al de las manecillas del reloj y seis de atrás para adelante, sobre una
superficie lisa y nivelada. Permitir que la mezcla solidifique dejando las
cajas Petri reposar sobre una superficie horizontal fría.
B.10.6.5 Preparar una caja control con 15 mL de medio
para verificar la esterilidad. Incluír un control adicional que considere la
esterilidad de la solución diluyente adicionando 1 mL directo de esta solución
en el mismo medio de cultivo.
B.10.6.6 Después de que está el medio completamente
solidificado en la caja, verter aproximadamente 4 mL del medio RVBA a 45 ±
B.10.6.7 Invertir las placas y colocarlas en la
incubadora a
B.10.6.8 Después del periodo especificado para la
incubación, contar las colonias con el contador de colonias.
B.10.6.9 Seleccionar las placas que contengan entre
15 y 150 colonias. Las colonias típicas son de color rojo oscuro, generalmente
se encuentran rodeadas de un halo de precipitación debido a las sales biliares,
el cual es de color rojo claro o rosa, la morfología colonial es semejante a
lentes biconvexos con un diámetro de
B.10.6.10 Para el caso de polvos, inocular 5 placas
con 2 mL de la dilución 1:10, contar las colonias encontradas en cada placa y
reportar la suma de UFC/g
B.10.7
Expresión de los Resultados
B.10.7.1
Cálculo del Método
B.10.7.1.1
Placas que contienen entre
15 y 150 colonias características.
Separar las placas que contienen el número
antes mencionado de colonias características en dos diluciones consecutivas.
Contar las colonias presentes. Calcular el número de coliformes por mililitro o
por gramo de producto, multiplicando el número de colonias por el inverso de la
dilución correspondiente, tomando los criterios de
B.10.7.1.2
Placas que contienen menos
de 15 colonias características.
Si cada una de las placas tiene menos de 15
colonias características, reportar el número obtenido seguido de la dilución
correspondiente.
B.10.7.1.3
Placas con colonias no
características.
Si en las placas no hay colonias
características, reportar el resultado como: menos de un coliforme por 1/d por
gramo, en donde d es el factor de dilución.
B.10.8
Informe de
Informar: UFC/g o mL en placa de agar rojo
violeta bilis, incubados a
B.11
Determinación de Staphylococcus aureus (Nota: El presente se deroga a partir del 17
de diciembre de 2016)
B.11.1
Fundamento
Este método permite hacer una estimación del
contenido de Staphylococcus aureus en
alimentos, se efectúa directamente en placas de medio de cultivo selectivo y
diferencial, con la confirmación mediante las pruebas de coagulasa y
termonucleasa. Este método es adecuado para el análisis de alimentos en los
cuales se esperen más de 100 células de Staphylococcus
aureus por g.
B.11.2
Materiales y Equipo
Todos los instrumentos que se utilicen para
trabajar la muestra deben esterilizarse mediante horno, durante 2 h de 170-
B.11.2.1 Cuchillos, pinzas, tijeras,
cucharas, espátulas y separador de huevo.
B.11.2.2 Tubos de cultivo de
B.11.2.3 Tubos de cultivo de
B.11.2.4 Cajas Petri de
B.11.2.5 Pipetas bacteriológicas de 1 mL y 10
mL de capacidad graduadas en 0,1 mL y 1 mL respectivamente y diámetro de
B.11.2.6 Pipetas Pasteur.
B.11.2.7 Probetas.
B.11.2.8 Varillas de vidrio de
B.11.2.9 Matraz Erlenmeyer con perlas de
vidrio
B.11.2.10 Cámara húmeda: consiste en una caja
Petri en la cual se coloca una varilla de vidrio en forma de "V"
rodeada de algodón humedecido con agua.
B.11.2.11 Horno para esterilizar que alcance
B.11.2.12 Autoclave con termómetro.
B.11.2.13 Baño de agua con regulador de
temperatura de 35 ± 0,5ºC.
B.11.2.14 Baño de agua con regulador de
temperatura de 45 ± 0,5ºC.
B.11.2.15 Balanza con capacidad no mayor de
B.11.2.16 Incubadora a 35 ±
B.11.3 Reactivos
En caso de disponerse de fórmulas comerciales
deshidratadas, para su preparación se deben seguir las instrucciones impresas
en la etiqueta respectiva.
Cuando se mencione agua debe entenderse que
se trata de "agua destilada".
Los reactivos a emplear en el método objeto
de esta norma deben ser grado analítico.
B.11.3.1 Soluciones
Diluyentes
B.11.3.1.1
Solución Reguladora de Fosfatos
(Solución concentrada)
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Fosfato monopotásico |
|
|
Agua |
|
Preparación
Disolver el fosfato en 500 mL de agua y
ajustar el pH a 7,2 con solución de hidróxido de sodio 1N, aforar con agua a
B.11.3.1.2
Agua Peptonada
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Peptona |
|
|
Cloruro de sodio |
|
|
Agua |
|
Preparación
Disolver los componentes en un litro de agua.
Ajustar el pH a 7,0 con solución de hidróxido de sodio 1N. Distribuir en
porciones de 99, 90 y 9 mL según se requiera. Esterilizar a
B.11.3.2
Medios de Cultivo
B.11.3.2.1
Medio de Baird-Parker
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Medio base (11.3.2.2) |
95,0 mL |
|
Solución de telurito de potasio (11.3.2.3) |
1,0 mL |
|
Emulsión de yema de huevo (11.3.2.4) |
5,0 mL |
Preparación
Cuando el medio base esté a
B.11.3.2.2
Medio base de Baird-Parker
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Triptona |
|
|
Extracto de levadura |
|
|
Extracto de carne |
|
|
Glicina |
|
|
Cloruro de litio |
|
|
Piruvato de sodio |
|
|
Agar |
|
|
Agua |
|
Preparación
Disolver los ingredientes o el agar base en
agua y calentar con agitación constante y hervir durante 1 min. Esterilizar a
En el caso de usar medio base deshidratado,
seguir las indicaciones del fabricante.
B.11.3.2.3
Solución de Telurito
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Telurito de potasio |
|
|
Agua |
100,0 mL |
Preparación
Disolver el telurito de potasio en agua y
esterilizar. La solución puede ser almacenada por varios meses a temperatura de
B.11.3.2.4
Emulsión de Yema de huevo
Preparación
Lavar con agua y jabón los huevos frescos que
sean necesarios y limpiarlos con una solución de tintura de yodo (solución
alcohólica al 2%) o sumergirlos en solución de cloruro mercúrico (1:1000).
Enjuagar con agua estéril y secar con gasa estéril. En campana de flujo laminar
o en condiciones asépticas, abrir los huevos y vaciarlos en un separador de
claras estéril. Transferir las yemas a una probeta hasta un volumen de 60 mL y
completar a 90 mL con solución salina isotónica. Verter la emulsión a un matraz
Erlenmeyer con perlas de vidrio estéril y agitar fuertemente para formar la
emulsión. Filtrar a través de gasa. Las placas deben utilizarse dentro de las
48 h siguientes a su preparación.
B.11.3.2.5
Solución Salina fisiológica
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Cloruro de sodio |
|
|
Agua |
100,0 mLl |
Preparación
Disolver el ingrediente en agua y esterilizar
a
B.11.3.2.6
Caldo de Infusión cerebro-corazón (BHI)
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Infusión de cerebro de ternera |
200,0 mL |
|
Infusión de corazón de res |
250,0 mL |
|
Peptona de gelatina |
|
|
Cloruro de sodio |
|
|
Fosfato disódico dodecahidratado |
|
|
Glucosa |
|
|
Agua |
|
Preparación
Disolver los ingredientes en agua y calentar
ligeramente si es necesario. Distribuir y esterilizar durante 15 min a
B.11.3.2.7
Acido Desoxirribonucleico helicoidal de timo de ternera.
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Acido desoxirribonucleico helicoidal de timo de ternera o equivalente |
|
|
Agar |
|
|
Cloruro de calcio anhidro (Solución |
0,10 mL |
|
Cloruro de sodio |
|
|
Azul de toluidina (Solución (11.3.2.9) |
0,30 mL |
|
Tris-(hidroximetil-aminometano) (Tris solución (11.3.2.10) |
100,00 mL |
Preparación
Disolver los ingredientes, excepto el azul de
toluidina agitando hasta completar la disolución del ácido desoxirribonucleico
y calentar a ebullición. Agregar el azul de toluidina. Distribuir en frascos
pequeños con tapón de hule. No es necesario esterilizar. Este medio es estable
a temperatura ambiente hasta 4 meses y funciona perfectamente aun después de
fundirlo varias veces. Tomar un porta objetos limpio y agregar 3 mL del medio
fundido esparciéndolo por la superficie. Cuando el agar solidifique, hacer
orificios con la punta de una pipeta Pasteur. Conservar en refrigeración para
evitar la deshidratación.
B.11.3.2.8
Solución de Cloruro de calcio anhidro
Cloruro de calcio PM = 110,99
Disolver
B.11.3.2.9
Solución de Azul de toluidina
Disolver
B.11.3.2.10
Solución Amortiguadora
(Tris pH 9) PM = 121,1
Disolver
B.11.3.2.11
Reactivo Biológico: Plasma de conejo
Emplear plasma de conejo deshidratado o
rehidratado siguiendo las instrucciones del fabricante y agregar ácido
etilendiaminotetracético (EDTA) en solución al 0,1% en plasma rehidratado. Si
se utiliza plasma deshidratado diluir con agua estéril en proporción de 1:3.
Puede emplearse plasma de conejo liofilizado adicionado de EDTA. No debe emplearse
sangre citratada.
B.11.4
Preparación de
La preparación de la muestra debe ser de
acuerdo a lo establecido en el numeral 9 de este apéndice normativo.
B.11.5
Procedimiento
B.11.5.1 Utilizando diferentes pipetas de 1 mL para
cada dilución, depositar 0,1 mL sobre la superficie de las placas de agar
Baird-Parker.
B.11.5.2 Distribuir el inóculo sobre la superficie
del agar con varillas estériles de vidrio en ángulo recto, utilizando una para
cada dilución.
B.11.5.3 Mantener las placas en su posición hasta que
el inóculo sea absorbido por el agar.
B.11.5.4 Invertir las placas e incubar de
B.11.5.5 Seleccionar las placas que tengan entre 15 y
150 colonias típicas de Staphylococcus
aureus; si no es posible, seleccionar las placas de las diluciones más
altas no obstante tengan más de 150 colonias.
B.11.5.6 Cuando las placas tengan menos de 15
colonias típicas también pueden ser utilizadas y al informe se debe agregar la
nota de "valor estimado".
B.11.5.7 Las colonias típicas son negras, circulares,
brillantes, convexas, lisas, de diámetro de
B.11.5.8 Seleccionar las colonias de acuerdo con el
siguiente cuadro para realizar las pruebas de coagulasa y termonucleasa:
CUADRO
|
NUMERO DE COLONIAS SOSPECHOSAS EN PLACA |
NUMERO DE COLONIAS POR PROBAR |
|
Menos de 50 |
3 |
|
|
5 |
|
|
7 |
|
< 3 |
Probarlas Todas |
B.11.5.9 Seleccionar el número de colonias y sembrar
cada una en tubos con 0,5 mL de caldo de infusión cerebro-corazón.
B.11.5.10 Incubar a
B.11.5.11 Inocular en la misma forma cepas conocidas
de Staphylococcus aureus y Staphylococcus epidermidis como testigos
positivo y negativo.
B.11.5.12 Después del periodo de incubación pasar con
una pipeta de 1 mL, 0,3 mL de cada cultivo a otro tubo de
B.11.5.13
Prueba de Coagulasa
B.11.5.13.1 Agregar a los 0,2 mL del cultivo anterior,
0,2 mL de plasma de conejo diluido volumen a volumen con solución salina
estéril.
B.11.5.13.2 Incubar en baño de agua de
B.11.5.13.3 Para comprobar la coagulabilidad del plasma
de conejo se añade una gota de cloruro de calcio al 5% a 0,5 mL de plasma
reconstituido empleado, formándose un coágulo en 10-15 seg.
B.11.5.14
Prueba de Termonucleasa
B.11.5.14.1 Calentar durante 15 min, 0,3 mL de cultivo
en caldo de infusión cerebro-corazón en baño de agua hirviendo.
B.11.5.14.2 Pasar una gota de cada cultivo por medio de
una pipeta Pasteur a un orificio del medio, incluye testigo.
B.11.5.14.3 Incubar a
B.11.5.14.4 La aparición de un halo color rosa extendido
de por lo menos
B.11.6
Cálculo
Hacer el cálculo del contenido de
microorganismos en el producto tomando en cuenta el número de colonias totales,
el número de colonias confirmadas, la dilución y el volumen inoculado (0,1 mL).
Ejemplo 1:
Si la caja tiene 80 colonias en la dilución
1:1000
Se toman 5 colonias para la prueba, de éstas
dan 4 positivas, el cálculo es:
![]()
Ejemplo 2:
Si la caja tiene 14 colonias en la dilución
1:10
Se toman 3 colonias para la prueba, de éstas
dan 2 positivas, el cálculo es:
![]()
B.11.7
Expresión de los Resultados
Según ejemplo 1:
Informar como Staphylococcus aureus 640 000 UFC/g
Según ejemplo 2:
Informar como Staphylococcus aureus 930 UFC/g valor estimado
Si las pruebas confirmativas resultan
negativas en todas las colonias probadas, informar como:
0 UFC/g en muestras directas
-10 UFC/g en muestras de dilución 1:10
-100 UFC/g en muestras de dilución 1:100
En la práctica los resultados pueden variar,
esto dependerá del técnico que trabaje el método y el grado de confiabilidad
del mismo, que en el 95% de los casos es de ± 16% a ± 52%.
B.12
Determinación de Salmonella spp. (Nota: El presente se deroga a partir del 17
de diciembre de 2016)
B.12.1
Fundamento
La presente técnica para la detección de Salmonella spp. en alimentos, describe
un esquema general que consiste de 5 pasos básicos:
Preenriquecimiento, es el paso donde la
muestra es enriquecida en un medio nutritivo no selectivo, que permite
restaurar las células de Salmonella dañadas
a una condición fisiológica estable.
Enriquecimiento selectivo, empleado con el
propósito de incrementar las poblaciones de Salmonella
spp. e inhibir otros organismos presentes en la muestra.
Selección en medios sólidos, en este paso se
utilizan medios selectivos que restringen el crecimiento de otros géneros
diferentes a Salmonella spp. y permite el reconocimiento visual de
colonias sospechosas.
Identificación bioquímica, este paso permite
la identificación genérica de los cultivos de Salmonella spp. y la eliminación de cultivos sospechosos falsos.
Serotipificación, es una técnica serológica
que permite la identificación específica de un cultivo.
B.12.2
Materiales y Equipo
B.12.2.1
Horno para esterilizar que
alcance los
B.12.2.2
Incubadora con termostato
para evitar variaciones mayores de ±
B.12.2.3
Autoclave con termómetro o
manómetro, probado con termómetro de máximas
B.12.2.4
Baño maría con termostato y
termómetro
B.12.2.5
Balanza granataria con
sensibilidad de
B.12.2.6
Licuadora de una o dos
velocidades controladas por un reóstato, con vasos esterilizables (vidrio o
aluminio)
B.12.2.7
Mecheros Bunsen o Fisher
B.12.2.8
Potenciómetro
B.12.2.9
Matraces Erlenmeyer de 500
mL
B.12.2.10
Recipientes de boca ancha,
de capacidad apropiada para contener las muestras simples y compuestas
B.12.2.11
Angulos de vidrio
B.12.2.12
Cucharas, bisturíes,
cuchillos y pinzas
B.12.2.13
Tubos de ensaye de 16 x
B.12.2.14
Tubos para serología de 10 x
B.12.2.15
Pipetas bacteriológicas de
10,0 y 5,0 mL, graduadas en 0,1 mL y protegidas con tapón de algodón
B.12.2.16
Pipetas de 1 mL , con
graduaciones de 0,01 mL.
B.12.2.17
Cajas de petri estériles de
vidrio o desechables
B.12.2.18
Rejillas para tubos de
ensaye
B.12.2.19
Asa de platino o nicromel de aproximadamente
B.12.2.20
Papel pH (intervalo de 6-8)
con graduaciones máximas de 0,4 unidades de pH para cambios de color
B.12.2.21
Todo el material que tenga
contacto con las muestras bajo estudio debe esterilizarse mediante: Horno,
durante 2 horas a 170-
B.12.2.22
Perilla
B.12.2.23
Vórtex
B.12.2.24
Estomacher (opcional)
B.12.3
Reactivos
En caso de disponerse de fórmulas comerciales
deshidratadas, se deben seguir las instrucciones impresas en la etiqueta
respectiva para su preparación.
Las sustancias químicas usadas para preparar
los medios de cultivo y los reactivos deben ser grado analítico.
B.12.3.1
Medios de Pre-enriquecimiento
B.12.3.1.1
Agua de Peptona tamponada
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Peptona |
|
|
Cloruro sódico |
|
|
Fosfato sódico dibásico |
|
|
Fosfato potásico monobásico |
|
|
Agua |
|
Preparación
Disolver los componentes en agua, calentando
si es necesario. Ajustar el pH, si es necesario, después de la esterilización a
7,0. Distribuir en recipientes de vidrio esterilizables con la capacidad
necesaria para obtener las porciones necesarias para la prueba. Esterilizar por
20 min a 121 ±
B.12.3.1.2
Caldo Lactosado
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Extracto de carne |
|
|
Peptona |
|
|
Lactosa |
|
|
Agua destilada pH final: 6,9 ± 0,2 |
|
Preparación
Disolver los ingredientes en agua, calentando
a
B.12.3.2
Caldo de Enriquecimiento
B.12.3.2.1
Caldo Selenito-cistina
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Triptona o polipeptona |
|
|
Lactosa |
|
|
Fosfato disódico |
|
|
Selenito ácido de sodio |
|
|
L-cistina |
|
|
Agua destilada pH final: 7,0 ± |
|
Preparación
Disolver los ingredientes en un litro de agua
destilada estéril y distribuir en volúmenes de 10 y 225 mL en recipientes
estériles, según se requiera. El caldo así preparado es transparente. De
preferencia usarlo el mismo día de su preparación. Si se desea conservar el
medio por varios días, puede exponerse al calor en autoclave por 5 min a
B.12.3.2.2
Caldo Tetrationato
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Proteosa peptona o triptona |
|
|
Sales biliares |
|
|
Carbonato de calcio |
|
|
Tiosulfato de sodio pentahidratado |
|
|
Agua destilada pH final: 7,0 ± 0,1 |
|
Preparación
Disolver los ingredientes en un litro de agua
destilada estéril. Distribuir, agitando constantemente, en porciones de 10 y
225 mL, en recipientes estériles. Guardar en refrigeración. Antes de usar el
medio, agregar 2 mL de una solución yodo-yoduro y 1 mL de solución de verde
brillante al 0,1% por cada 100 mL de caldo. El medio una vez adicionado de yodo
no debe calentarse y debe usarse el mismo día de su preparación
B.12.3.2.3
Vassiliadis-Rappaport
Solución
A
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Triptona |
|
|
Cloruro de sodio |
|
|
Fosfato de potasio dihidrogenado |
|
|
Agua destilada |
|
Disolver los componentes en agua por
calentamiento cercano a
Solución
B
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Cloruro de magnesio hexahidratado |
|
|
Agua destilada |
|
Disolver el cloruro de magnesio en agua. Como
esta sal es muy higroscópica es conveniente disolver el contenido entero de
cloruro de magnesio desde un recipiente recientemente abierto de tal modo que
la concentración de la solución sea de 0,4 g/mL. Conservar en frasco ámbar a
temperatura ambiente.
Solución
C
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Oxalato de verde de malaquita |
|
|
Agua destilada |
100,0 mL |
Disolver el oxalato de verde de malaquita en
agua. Conservar en frasco ámbar a temperatura ambiente.
Medio
completo
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
solución A |
1000 mL |
|
solución B |
100 mL |
|
solución C |
10 mL |
Preparación
Adicionar 1000 mL de la solución A, 100 mL de
la solución B y 10 mL de la solución C. Ajustar el pH si es necesario, de tal
manera que después de la esterilización sea de 5,2. Distribuir antes de usar
dentro de tubos en cantidades de 10 mL. Almacenar en refrigeración.
B.12.3.2.4
Caldo de Soya tripticasa
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Tripticasa o triptosa |
|
|
Fitona |
|
|
Glucosa |
|
|
Cloruro de sodio |
|
|
Agua destilada pH final: 7,3 ± 0,2 |
|
Preparación
Disolver los ingredientes en
B.12.3.2.5
Leche descremada reconstituida
Suspender
B.12.3.2.6
Caldo Soya tripticasa estéril adicionado con sulfito de potasio
Adicionar al caldo soya tripticasa
B.12.3.3
Medios de Aislamiento
B.12.3.3.1
Agar verde brillante (VB)
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Extracto de levadura |
|
|
Polipeptona (Proteosa peptona No. 3) |
|
|
Cloruro de sodio |
|
|
Lactosa |
|
|
Sacarosa |
|
|
Rojo de fenol |
|
|
Agar |
|
|
Verde brillante |
|
|
Agua destilada pH final: 6,9 ± 0,2 |
|
Preparación
Suspender los ingredientes en un litro de
agua destilada y calentar a ebullición, hasta disolución completa. Ajustar el
pH. Esterilizar en autoclave por 15 min a
B.12.3.3.2
Agar con sulfito de bismuto
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Extracto de carne de res |
|
|
Mezcla de peptonas |
|
|
Glucosa |
|
|
Fosfato disódico (anhidro) |
|
|
Sulfato ferroso (anhidro) |
|
|
Sulfito de bismuto |
|
|
Verde brillante |
|
|
Agar |
|
|
Agua destilada pH final: 7,6 ± 0,2 |
|
Preparación
Suspender los ingredientes en un litro de
agua. Calentar hasta su disolución completa, agitando frecuentemente. Ajustar
el pH. Enfriar a
B.12.3.3.3
Agar xilosa lisina desoxicolato (XLD)
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Xilosa |
|
|
L-lisina |
|
|
Lactosa |
|
|
Sacarosa |
|
|
Cloruro de sodio |
|
|
Extracto de levadura |
|
|
Rojo de fenol |
|
|
Agar |
|
|
Desoxicolato de sodio |
|
|
Citrato férrico-amónico |
|
|
Tiosulfato de sodio |
|
|
Agua destilada pH final: 6,9 ± 0,2 |
|
Preparación
Suspender los ingredientes en un litro de
agua destilada, y calentar en baño de agua a
B.12.3.3.4
Agar para Salmonella y Shigella (SS)
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Extracto de carne |
|
|
Polipeptona |
|
|
Lactosa |
|
|
Sales biliares |
|
|
Citrato de sodio dihidratado |
|
|
Tiosulfato de sodio pentahidratado |
|
|
Citrato férrico |
|
|
Agar |
|
|
Rojo neutro |
|
|
Verde brillante |
0,330 mg |
|
Agua destilada pH final: 7,0 ± 0,2 |
|
Preparación
Suspender los ingredientes en un litro de
agua destilada estéril y calentar a ebullición hasta disolución completa.
Ajustar el pH. No esterilizar en autoclave. Enfriar a
Nota: La polipeptona se puede sustituir por
B.12.3.3.5
Agar Entérico Hektoen
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Proteosa peptona |
|
|
Extracto de levadura |
|
|
Lactosa |
|
|
Sacarosa |
|
|
Salicina |
|
|
Sales biliares |
|
|
Cloruro de sodio |
|
|
Tiosulfato de sodio |
|
|
Citrato amónico férrico |
|
|
Azul de bromotimol |
|
|
Fuscina ácida |
|
|
Agar |
|
|
Agua pH final: 7,5 ± 0,2 |
|
Preparación
Suspender los ingredientes en agua destilada,
hervir con agitación hasta completa disolución del agar. No sobrecalentar.
Dejar enfriar a 55-
B.12.3.4
Medios para Pruebas Bioquímicas
B.12.3.4.1 Agar
de tres azúcares y hierro (TSI)
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Peptona de carne |
|
|
Peptona de caseína |
|
|
Cloruro de sodio |
|
|
Lactosa |
|
|
Sacarosa |
|
|
Glucosa |
|
|
Agar |
|
|
Rojo de fenol |
2,5 mg |
|
Sulfato ferroso amónico pentahidratado |
20,0 mg |
|
Tiosulfato de sodio |
20,0 mg |
|
Agua destilada pH final: 7,3 ± 0,2 |
100,0 mL |
Preparación
Suspender los ingredientes en 100 mL de agua
destilada. Calentar a ebullición, agitando ocasionalmente, hasta disolución
completa. Enfriar a
Nota: Las peptonas se pueden sustituir por
B.12.3.4.2
Agar de Hierro y Lisina (LIA)
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Peptona de gelatina |
|
|
Extracto de levadura |
|
|
Glucosa |
|
|
L-lisina |
|
|
Citrato férrico-amónico |
50,0 mg |
|
Tiosulfato de sodio anhidro |
4,0 mg |
|
Púrpura de bromocresol |
2,0 mg |
|
Agar |
|
|
Agua destilada pH final: 6,7 ± 0,2 |
100,0 mL |
Preparación
Suspender los ingredientes en el agua
destilada y mezclar bien, calentar hasta ebullición con agitación frecuente
hasta conseguir la disolución completa. Ajustar el pH. Distribuir en volúmenes
de 3 mL en tubos de 13 x
B.12.3.4.3
Agar Nutritivo
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Extracto de carne |
|
|
Peptona |
|
|
Agar |
|
|
Agua destilada pH final: 6,8 ± 0,2 |
|
Preparación
Suspender los ingredientes en agua. Dejar
reposar de
B.12.3.4.4.
Medio de SIM (para Sulfuro, Indol y Movilidad)
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Extracto de carne |
|
|
Peptona |
|
|
Hierro peptonizado |
|
|
Tiosulfato de sodio |
|
|
Agua destilada pH final: 7,3 ± 0,2 |
|
Preparación
Suspender los ingredientes en el agua
destilada, calentar a ebullición agitando frecuentemente hasta lograr una
disolución completa. Enfriar a
B.12.3.4.5
Agar Citrato de Simmons
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Fosfato de amonio |
|
|
Fosfato dipotásico |
|
|
Cloruro de sodio |
|
|
Citrato de sodio |
|
|
Sulfato de magnesio |
|
|
Azul de bromotimol |
|
|
Agar |
|
|
Agua destilada pH final: 6,8 ± 0,2 |
|
Preparación
Suspender los ingredientes en el agua
destilada, calentar a ebullición agitando frecuentemente hasta lograr una
disolución completa. Ajustar el pH. Distribuir el medio en volúmenes de 3 mL en
tubos de 13 x
B.12.3.4.6
Caldo MR-VP (Rojo de metilo-Voges Proskauer)
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Peptona |
|
|
Dextrosa |
|
|
Difosfato de potasio |
|
|
Agua destilada pH final: 6,9 ± 0,2 |
|
Preparación
Suspender los ingredientes en el agua
destilada, calentar a ebullición agitando frecuentemente hasta lograr una
disolución completa. Ajustar el pH. Distribuir el medio en volúmenes de 3 mL en
tubos de 13 x
B.12.3.4.7
Caldo Manitol
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Extracto de carne |
|
|
Proteosa peptona |
|
|
Cloruro de sodio |
|
|
Rojo de fenol |
|
|
Manitol |
|
|
Agua pH final: 7,4 ± 0,2 |
|
Preparación
Suspender
B.12.3.4.8
Caldo Malonato
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Extracto de levadura |
|
|
Sulfato de amonio |
|
|
Fosfato dipotásico |
|
|
Fosfato monopotásico |
|
|
Cloruro de sodio |
|
|
Malonato |
|
|
Glucosa |
|
|
Azul de bromotimol |
|
|
Agua pH final: 6,7 ± 0,2 |
|
Preparación
Suspender los ingredientes en agua, mezclar y
ajustar el pH. Distribuir en tubos de 13 x
B.12.3.4.9
Caldo Urea
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Urea |
|
|
Extracto de levadura |
|
|
Fosfato monopotásico |
|
|
Fosfato disódico |
|
|
Rojo de fenol |
|
|
Agua pH final: 6,8 ± 0,2 |
|
Preparación
Disolver los ingredientes en agua destilada.
NO CALENTAR. Esterilizar por filtración a través de membrana 0,45 µm o en
autoclave de
B.12.3.4.10
Caldo de Urea Rápido
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Urea |
|
|
Extracto de levadura |
|
|
Fosfato monopotásico |
|
|
Fosfato disódico |
|
|
Rojo de fenol |
|
|
Agua pH final: 6,8 ± 0,2 |
|
Preparación
Disolver los ingredientes en agua destilada.
NO CALENTAR. Esterilizar por filtración a través de membrana 0,45 µm.
Distribuir asépticamente de
B.12.3.4.11
Caldo Infusión Cerebro Corazón
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Infusión cerebro corazón |
|
|
Infusión de corazón de res |
|
|
Proteosa peptona |
|
|
Cloruro de sodio |
|
|
Fosfato disódico dodecahidratado |
|
|
Dextrosa |
|
|
Agua destilada pH final: 7,4 ± 0,2 |
|
Preparación
Disolver los ingredientes en agua destilada,
calentar suavemente. Distribuir y esterilizar a
B.12.3.5
Soluciones
B.12.3.5.1
Solución Verde Brillante al 0,1% (1:1000)
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Verde brillante |
|
|
Agua destilada estéril |
100,0 mL |
Disolver
B.12.3.5.2
Solución de Yodo-yoduro
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Cristales de yodo |
|
|
Yoduro de potasio |
|
|
Agua destilada |
100,0 mL |
Disolver los cristales y el yoduro de potasio
en agua destilada hasta completar 100 mL. Conservar en frasco ámbar.
B.12.3.5.3
Solución Salina al 0,85%
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Cloruro de sodio |
|
|
Agua destilada |
100,00 mL |
Disolver el cloruro de sodio en el agua y
esterilizar a
B.12.3.5.4
Solución Salina formalizada
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Solución de formaldehído (36-38%) |
6,0 mL |
|
Cloruro de sodio |
|
|
Agua destilada |
|
Disolver
B.12.3.5.5
Reactivo de Kovac
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
p-dimetil-aminobenzaldehído |
|
|
Alcohol amílico 75,0 mL |
75,0 mL |
|
Acido clorhídrico concentrado 25,0 mL |
25,0 mL |
Disolver el p-dimetil-aminobenzaldehído en el
alcohol amílico y después agregar el ácido clorhídrico lentamente. Conservar en
frasco ámbar en refrigeración.
B.12.3.5.6
Solución de Alfa-naftol al 5%
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Alfa-naftol |
|
|
Alcohol |
100,0 mL |
Disolver
B.12.3.5.7
Solución de Rojo de metilo
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Rojo de metilo |
|
|
Alcohol etílico |
300,00 mL |
|
Agua destilada c.b.p. |
500,00 mL |
Disolver el rojo de metilo en el alcohol
etílico y adicionar agua hasta completar 500 mL.
B.12.3.5.8
Solución de Hidróxido de potasio al 40%
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Hidróxido de potasio |
|
|
Agua destilada |
100,0 mL |
Disolver
B.12.3.5.9
Solución de Gelatinasa al 5%
FORMULA
|
INGREDIENTES |
CANTIDADES |
|
Gelatinasa |
|
|
Agua |
100,0 mL |
Disolver
B.12.3.6
Antisueros
Antisuero
polivalente somático (O)
Antisuero
polivalente flagelar (H)
Antisuero
Vi
B.12.4
Procedimiento
B.12.4.1
Preparación de los alimentos para el aislamiento de Salmonella.
Los siguientes métodos se basan en el
análisis de
B.12.4.1.1
Procedimiento general para la preparación de muestras.
Pesar asépticamente
B.12.4.1.2
Procedimiento específico para la preparación de muestra según el producto.
B.12.4.1.2.1
Leche en polvo, entera, semidescremada o descremada.
Seguir el procedimiento general para el
pesado de la muestra y adicionarla lentamente a un matraz Erlenmeyer con 1 lt
de agua estéril, 2 mL al 1% de verde brillante, procurando que el polvo quede
en la superficie del líquido y se hidrate suavemente. De esta solución se toman
225 mL para disolver la muestra. Dejar la mezcla en reposo por 60 min, e
incubar como se indica en B.12.4.1.1.
B.12.4.1.2.2
Queso
Proceder igual que en B.12.4.1.1 utilizando
agua de peptona tamponada como medio de preenriquecimiento.
B.12.4.1.2.3
Productos procesados térmicamente y productos secos.
Se sigue el procedimiento señalado en B.12.4.1.1
hasta la homogeneización. Si la muestra es en polvo o molida, el licuado puede
omitirse. Después de reposar, mezclar bien y ajustar el pH como se indica en el
procedimiento general. Para emulsionar las grasas, adicionar hasta un máximo de
2,25 mL de Tergitol aniónico 7 estéril (
B.12.4.1.2.4
Productos crudos o altamente contaminados.
Pesar porciones de
B.12.4.1.2.5
Dulces y dulces cubiertos
Pesar asépticamente
B.12.4.2
Aislamiento de Salmonella spp.
B.12.4.2.1
Cerrar firmemente el tapón
de rosca de los matraces con los cultivos de preenriquecimiento y agitar
suavemente, transferir respectivamente 1 mL de la mezcla a un tubo que contenga
10 mL de caldo tetrationato y a otro con 10 mL de caldo selenito cistina. Como
alternativa, en sustitución del caldo tetrationato puede emplearse el medio
Vassiliadis-Rappaport.
B.12.4.2.2
Incubar de
B.12.4.2.3
Mezclar el tubo con caldo
selenito cistina y estriar en agar xilosa lisina desoxicolato (XLD), agar verde
brillante (VB) y una tercera caja con cualquiera de los medios selectivos
adicionales (agar entérico Hektoen, agar Sulfito de Bismuto o Agar SS).
Efectuar el mismo procedimiento para el caldo tetrationato. Incubar las placas
24 ± 2 h a
B.12.4.2.4
Examinar las placas para investigar
la presencia de colonias típicas de Salmonella,
de acuerdo con las siguientes características:
Agar XLD: colonias rosas o rojas que pueden
ser transparentes con o sin centro negro. En algunos casos las colonias pueden
aparecer completamente negras.
Agar VB: colonias rojas o rosas que pueden
ser transparentes rodeadas por medio enrojecido; las bacterias fermentadoras de
la lactosa dan colonias amarillas.
Agar entérico Hektoen: colonias verdes o
azulverdes con o sin centro negro. En algunos casos las colonias pueden
aparecer completamente negras.
Agar Sulfito de Bismuto: las colonias típicas
de Salmonella pueden ser cafés,
grises o negras; con o sin brillo metálico. Generalmente el medio circundante
(halo) es café, tornándose posteriormente negro.
Algunas cepas producen colonias verdes sin la
formación del halo oscuro. Si las placas no muestran colonias típicas o no se
observa crecimiento, incubar 24 h adicionales.
Agar SS: colonias translúcidas,
ocasionalmente opacas. Algunas colonias dan centro negro. Las colonias
fermentadoras de la lactosa son rojas.
B.12.4.3
Identificación Bioquímica
B.12.4.3.1
Seleccionar al menos dos
colonias típicas de cada medio selectivo, que se encuentren bien aisladas.
Tocar levemente el centro de cada colonia e inocular dos tubos, uno con agar
triple azúcar hierro (TSI) y otro con agar hierro lisina (LIA), por estría en
la superficie inclinada y por punción en el fondo. Incubar por 24 ± 2 h a
B.12.4.3.2
Observar el crecimiento en
los tubos y considerar presuntivamente positivas para Salmonella las colonias que den las siguientes reacciones:
B.12.4.3.2.1
Agar TSI, en el fondo del
tubo se observa vire del indicador debido a la fermentación de la glucosa; en
la superficie del medio se observa un color rojo más intenso que el medio
original debido a la no fermentación de la lactosa ni de la sacarosa. En la
mayoría de los casos se observa coloración negra a lo largo de la punción
debido a la producción de ácido sulfihídrico.
B.12.4.3.2.2
Agar LIA, se observa
intensificación del color púrpura en todo el tubo por la descarboxilación de la
lisina. Considerar negativos aquellos cultivos que produzcan claramente color
amarillo en el fondo del agar. La mayoría de las cepas de Salmonella producen ácido sulfihídrico en este medio con
ennegrecimiento a lo largo de la punción.
B.12.4.3.2.3
Retener todos los cultivos
que muestren las reacciones características de Salmonella en los medios TSI y LIA para las pruebas adicionales,
indicadas en B.12.4.3.3.
B.12.4.3.3
Los cultivos con TSI que no
parecen de Salmonella spp. pero que
presentan reacciones en LIA típicos, deben trabajarse como cultivos presuntivos
positivos, ya que en estos casos, el medio LIA permitirá detectar S. arizonae y cepas atípicas de Salmonella que utilicen lactosa o
sacarosa. Descartar solamente los cultivos que muestren reacciones atípicas en
ambos medios.
B.12.4.3.4
Continuar el análisis a
partir de los tubos de TSI con reacciones típicas. Si el cultivo presenta
reacciones atípicas en este medio, tomar colonias adicionales de las placas de
donde se obtuvo el cultivo atípico anterior y sembrar las pruebas bioquímicas
nuevamente.
B.12.4.3.5
Continuar la identificación
bioquímica y serológica a partir de los cultivos recuperados de TSI. Se
recomienda trabajar seis cultivos por cada
B.12.4.3.6
Prueba de Ureasa
B.12.4.3.6.1
Prueba de Ureasa (convencional). Con un asa estéril, tomar crecimiento del cultivo presumiblemente
positivo de cada tubo de medio TSI e inocular tubos de caldo urea. Utilizar un
control de medio para comparar el vire púrpura de las reacciones positivas con
el color del medio original. Incubar 24 ± 2 h a
B.12.4.3.6.2
Prueba de Ureasa (rápida).
Tomar dos asadas de crecimiento del cultivo presumiblemente positivo de cada
tubo de medio TSI e inocular tubos de caldo urea (rápida). Incubar 2 h a 37 ±
B.12.4.4
Identificación Serológica
B.12.4.4.1
Ensayo de los Antígenos somáticos de Salmonella
(Antisuero polivalente O)
B.12.4.4.1.1
Colocar con un asa dos gotas
separadas de solución salina estéril sobre un portaobjetos o en dos secciones
de una placa para aglutinación. Suspender en cada una de las gotas, una porción
del cultivo desarrollado en TSI.
B.12.4.4.1.2
Agregar a una de ellas una
gota del antisuero polivalente somático (O) y mezclar con el canto del asa o
empleando aplicadores de madera.
B.12.4.4.1.3
Agitar inclinando la lámina
hacia atrás y hacia adelante durante aproximadamente un min. Observar bajo
buena iluminación sobre un fondo oscuro.
B.12.4.4.1.4
Considerar cualquier grado
de aglutinación como positiva. La prueba positiva resulta cuando se presenta
aglutinación en la gota con el cultivo y el antisuero y no aglutinación en la
gota que contiene el cultivo y la solución salina. Si se observa aglutinación
en ambas gotas, la prueba no es definitiva y se debe continuar con las pruebas
bioquímicas complementarias.
B.12.4.4.2
Cuando la aglutinación es
positiva con el suero polivalente O, puede determinarse el subgrupo empleando
antisueros para los diferentes subgrupos (los grupos B, C, D y E, suelen ser
los más frecuentes).
B.12.4.4.2.1
Si la aglutinación con el
antisuero O es negativa, utilizar antisuero Vi y efectuar la prueba. Si hay
aglutinación con Vi calentar el cultivo a ebullición y repetir la aglutinación
con el antisuero polivalente O.
B.12.4.4.2.2
Si no se cuenta con los
sueros grupoespecíficos, solicitar la tipificación de la cepa al Laboratorio de
Enterobacterias del Centro Nacional de Diagnóstico y Referencia de
B.12.4.4.3
Si se requiere, practicar el
ensayo de los antígenos flagelares de Salmonella
(Antisuero polivalente H).
B.12.4.4.3.1
Inocular el crecimiento del
tubo de TSI en agar infusión de cerebro corazón e incubar de
B.12.4.4.3.2
Colocar 0,5 mL del antisuero
polivalente flagelar (H) preparado en un tubo para serología (13 x
B.12.4.5
Pruebas Bioquímicas Complementarias
Cuando las pruebas serológicas o bioquímicas
iniciales, dan resultados atípicos o no concluyentes, realizar las pruebas que
se describen a continuación:
B.12.4.5.1
Inocular los cultivos
positivos provenientes de TSI y LIA en: medio SIM, agar citrato de Simmons,
caldo manitol y caldo RM-VP. Usar caldo malonato para confirmar la presencia de
la especie S. arizonae.
B.12.4.5.2
Interpretar los cambios en
los medios inoculados conforme lo siguiente:
B.12.4.5.2.1
Agar Citrato de Simmons
Inocular por estría el tubo. Incubar 96 ± 2 h
a 35 ±
Prueba positiva: crecimiento acompañado de un
cambio de color de verde a azul.
Prueba negativa: ausencia de crecimiento y
sin cambio de color.
B.12.4.5.2.2
Medio SIM
Inocular por punción. Incubar 24 h a 35 ±
Prueba positiva: crecimiento a lo largo de la
punción y en el seno del medio de cultivo.
Prueba negativa: crecimiento a lo largo de la
punción exclusivamente.
Producción de ácido sulfihídrico.
Prueba positiva: desarrollo de un color negro
a lo largo de la punción que puede extenderse a todo el medio.
Prueba negativa: ausencia de color negro.
Producción de indol.
Adicionar al tubo con medio SIM que presente
crecimiento, de
Prueba positiva: desarrollo de un anillo de
color rojo.
Prueba negativa: sin cambio de color.
B.12.4.5.2.3
Caldo RM-VP
Inocular un tubo con el medio.
Incubar 48 ± 2 h a 35 ±
B.12.4.5.2.4
Prueba de Voges-Proskauer (VP)
Transferir a un tubo un mL del cultivo de 48
h. Adicionar 0,6 mL de solución de alfa naftol. Adicionar 0,2 mL de solución de
hidróxido de potasio 40%. Adicionar algunos cristales de creatinina (opcional).
Interpretar los resultados después de incubar 2 h a 35 ±
Prueba positiva: desarrollo de color rojo
ladrillo.
Prueba negativa: sin cambio de color.
Reincubar el resto del medio RM-VP 48 h más a
35 ±
B.12.4.5.2.5
Prueba de Rojo de metilo (RM)
Adicionar al medio de cultivo de 96 h de
incubación de dos a tres gotas de solución de rojo de metilo. Interpretar los
resultados inmediatamente.
Prueba positiva: desarrollo de color rojo.
Prueba negativa: desarrollo de color
amarillo.
B.12.4.5.2.6
Caldo Malonato
Inocular un tubo conteniendo el medio.
Incubar 40 ± 2 h a 35 ±
Prueba positiva: desarrollo de color azul.
Prueba negativa: sin cambio de color.
B.12.4.5.2.7
Caldo Manitol
Inocular un tubo conteniendo el medio.
Incubar 24 ± 2 h a 35 ±
Prueba positiva: desarrollo de color
amarillo.
Prueba negativa: sin cambio de color.
B.12.4.5.3
Consultar los resultados obtenidos en el cuadro 2 para la identificación de los
géneros de las bacterias investigadas.
Nota:
los sistemas bioquímicos
comerciales validados pueden ser usados como alternativa para las pruebas
bioquímicas convencionales.
B.12.4.6
Cálculo y Expresión de Resultados
B.12.4.6.1
Interpretación de reacciones
bioquímicas y serológicas.
CUADRO 1
|
Reacciones
bioquímicas |
Reacciones
serológicas |
Interpretación |
|
Típica |
Antígeno O Vi o H positivo |
Cepas consideradas como Salmonella spp. |
|
Típica |
Todas las reacciones negativas |
|
|
Típica |
No probada |
Puede ser Salmonella spp. |
|
Reacciones atípicas |
Antígeno O, Vi o H positivo |
|
|
Reacciones atípicas |
Todas las reacciones negativas |
No debe ser considerada Salmonella spp. |
Nota:
Ver imagen 1 al final del
método.
B.12.4.6.2
Reacciones Bioquímicas y Serológicas de Salmonella
spp.
CUADRO 2
|
Prueba o
sustrato |
Positivo |
Negativo |
Reacción |
|
Glucosa (TSI) |
amarillo |
rojo |
+ |
|
Lisina descarboxilasa(LIA) |
púrpura |
amarillo |
+ |
|
H2S (TSI y LIA) |
negro |
no negro |
+ |
|
Ureasa |
rojo-púrpura |
no hay cambio de color |
- |
|
Caldo de lisina descarboxilasa |
púrpura |
amarillo |
+ |
|
Caldo dulcitol rojo de fenol |
amarillo o gas |
no hay cambio de color ni gas |
+ b |
|
Caldo KCN |
crecimiento |
no hay crecimiento |
- |
|
Caldo malonato |
azul |
no hay cambio de color |
- c |
|
Prueba de indol |
superficie color violeta |
superficie color amarillo |
- |
|
Prueba del antígeno flagelar |
aglutinación |
no hay aglutinación |
+ |
|
Prueba del antígeno somático |
aglutinación |
no hay aglutinación |
+ |
|
Caldo lactosa rojo fenol |
amarillo o gas |
no hay cambio de color ni gas |
- c |
|
Caldo sacarosa rojo fenol |
amarillo o gas |
no hay cambio de color ni gas |
- |
|
Prueba Voges- Proskauer |
de rosa a rojo |
no hay cambio de color |
- |
|
Prueba rojo de metilo |
rojo difuso |
amarillo difuso |
+ |
|
Citrato de Simmons |
crecimiento color azul |
no hay crecimiento, no hay cambio de color |
v |
a +, 90% o más positivos en 1 o 2 días; -, 90%
o más negativas en 1 o 2 días;v, variable.
b La mayoría de los cultivos S. arizonae son negativos.
c La mayoría de los cultivos S. arizonae son positivos.
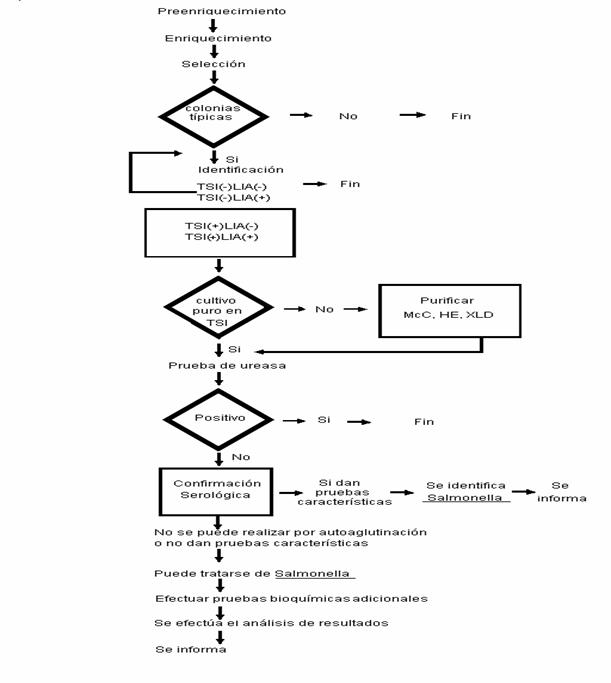
IMAGEN 1. Diagrama de Flujo para la determinación de Salmonella spp.
B.12.4.7
Informe de Resultados
Informar:
Presencia o Ausencia de Salmonella en
__________ g o ____________ mL de muestra.
B.13
Determinación de Listeria monocytogenes.
(Nota: El presente se deroga a
partir del 20 de junio de 2016)
B.13.1
Fundamento
El método para detectar la presencia de L. monocytogenes se basa en el
aislamiento y la diferenciación de especies de Listeria spp., principalmente por la fermentación de carbohidratos
y la actividad hemolítica de los miembros de este género.
B.13.2
Materiales y Equipo
B.13.2.1
Aceite de inmersión
B.13.2.2
Asas bacteriológicas
B.13.2.3
Cajas Petri
B.13.2.4
Cubreobjetos
B.13.2.5
Matraces Erlenmeyer de 500
mL
B.13.2.6
Lámpara de luz blanca
B.13.2.7
Lápiz graso o marcador
B.13.2.8
Lupa de bajo aumento
B.13.2.9
Pipetas volumétricas de 25,
10 y 1,0 mL
B.13.2.10
Portaobjetos escavado
B.13.2.11
Portaasas
B.13.2.12
Tubos de 16 x
B.13.2.13
Tubos de 13 x
B.13.2.14
Sistema de filtración con
membranas con un tamaño de poro de 0,45 µm
B.13.2.15
Horno para esterilizar que
alcance una temperatura mínima de
B.13.2.16
Autoclave con termómetro y
manómetro, calibrada con termómetro de máximas y mínimas.
B.13.2.17
Baño de agua con control de
temperatura y circulación mecánica, provista con termómetro calibrado con
divisiones de
B.13.2.18
Licuadora de una o dos velocidades
controladas por un reóstato o bien un homogeneizador peristáltico (Stomacher).
B.13.2.18
Vasos para licuadora con
tapa esterilizables o bolsas estériles para homogeneizador peristáltico.
B.13.2.20
Balanza granataria con
sensibilidad de
B.13.2.21
Incubadoras con termostato
que evite variaciones mayores de ± 1,0ºC, provista con termómetro calibrado.
B.13.2.22
Microscopio de contraste de
fases con objetivo de inmersión en aceite (100 X) o microscopio de campo
oscuro.
B.13.3
Reactivos
Los reactivos que a continuación se mencionan
deben ser grado analítico.
Cuando se indica agua, debe entenderse que se
trata de agua destilada.
B.13.3.1
Acido acético 5 N
B.13.3.2
Acido clorhídrico
B.13.3.3
Acido sulfanílico
(cristales)
B.13.3.4
Alfa-naftilamina
B.13.3.5
Alfa-naftol 5% en etanol
absoluto
B.13.3.6
Etanol absoluto
B.13.3.7
Granalla de zinc
B.13.3.8
Hidróxido de sodio
B.13.3.9
Lactamato de glicil-glicina
(anhídrido de glicina)
B.13.3.10
Regulador de fosfatos
glicerinado con pH 9,0 ± 0,2
B.13.3.11
Sangre de carnero
desfibrinada
B.13.3.12
Solución al 3% de peróxido
de hidrógeno
B.13.3.13
Solución salina fisiológica
0,85% estéril
B.13.3.14
Sueros comerciales para
tipificación de Listeria spp
B.13.3.15
Sulfato de cadmio al 20%
B.13.3.16
Zinc pulverizado
B.13.3.17
Reactivos para Tinción de Gram
B.13.3.17.1 Alcohol-acetona
|
Ingredientes |
Cantidad |
|
Etanol
(95%) |
700,0 mL |
|
Acetona
|
300,0 mL |
Mezclar ambos líquidos.
B.13.3.17.2
Cristal Violeta
Solución A
|
Ingredientes |
Cantidad |
|
Cristal violeta |
|
|
Etanol (95%) |
20,0 mL |
Disolver el cristal violeta en el etanol.
Solución B
|
Ingredientes |
Cantidad |
|
Oxalato de amonio |
|
|
Agua |
80,0 mL |
Disolver el oxalato de amonio en el agua.
Después de preparar las soluciones A y B,
verter una en la otra y agitar hasta que se mezclen perfectamente.
B.13.3.17.3
Solución de Yodo
|
Ingredientes |
Cantidad |
|
Yodo |
|
|
Yoduro
de potasio |
|
|
Agua
|
300,0 mL |
Triturar finamente el yodo y el yoduro de
potasio en un mortero, de ser posible en una campana de extracción. Añadir una
pequeña cantidad de agua para lavar el material, agregar el resto del agua y
agitar.
Nota:
¡Evitar el contacto de los
reactivos con la piel!
B.13.3.17.4
Solución de Safranina
|
Ingredientes |
Cantidad |
|
Safranina |
|
|
Etanol (95%) |
10,00 mL |
|
Agua |
100,00 mL |
Disolver la safranina en el etanol, mezclar,
agregar el agua y volver a agitar. Filtrar la solución con papel filtro.
B.13.3.18
Reactivos para
B.13.3.18.1
Reactivo A
|
Ingredientes |
Cantidad |
|
Alfa-naftilamina
|
|
|
Acido
acético 5N |
100,0 mL |
B.13.3.18.2
Reactivo B
|
Ingredientes |
Cantidad |
|
Acido
sulfanílico |
|
|
Acido
acético 5N |
125,0 mL |
B.13.3.18.3
Reactivo C
|
Ingredientes |
Cantidad |
|
|
|
|
Acido
acético 5N |
200,0 mL |
B.13.3.18.4
Solución de Sulfato de cadmio al 20%
Colocar granallas de zinc en solución de
sulfato de cadmio al 20% de
B.13.4
Medios de Cultivo
A continuación se presentan las fórmulas y
los procedimientos para preparar los medios empleados en este análisis
microbiológico. En caso de disponer de fórmulas comerciales deshidratadas se
deben seguir las instrucciones del fabricante para su preparación.
B.13.4.1
Caldo soya tripticaseína con 0,6 % de extracto de levadura (CSTEL)
|
Ingredientes |
Cantidad |
|
Caldo
soya tripticaseína |
|
|
Extracto
de levadura |
|
|
Agua
|
1000,0 mL |
Agitar hasta disolver los ingredientes.
Esterilizar a 121 ±
B.13.4.2
Caldo de Enriquecimiento (EB) pH 7,3
Un litro de caldo soya tripticaseína con
extracto de levadura (CSTEL) debe contener los siguientes suplementos:
|
Suplementos |
Cantidad |
|
Clorhidrato
de acriflavina |
15,0 mg |
|
Acido
nalidíxico (sal sódica) |
40,0 mg |
|
Cicloheximida
|
50,0 mg |
|
Acido
pirúvico (sal sódica) solución
al 10 % (p/v) * |
11,1 mL |
* Utilizar solamente cuando se sospeche que
las células de Listeria estén
dañadas. (Ver el punto B.13.6.1)
Preparar los suplementos de acriflavina y
nalidíxico a partir de una solución al 0,5 % (p/v) con agua. El suplemento de
cicloheximida prepararlo como una solución al 1,0 % (p/v) en una solución al 40
% (v/v) de etanol en agua. Esterilizar por filtración los suplementos. Agregar
en condiciones asépticas los suplementos al medio CSTEL previamente
esterilizado, justo antes de su uso. Para la preparación de un litro del medio
CSTEL se debe partir de las soluciones anteriores, agregando las siguientes
cantidades: 3,0 mL de acriflavina, 8,0 mL de ácido nalidíxico y 5,0 mL de
solución de cicloheximida.
Precaución:
¡La cicloheximida es una
sustancia química altamente tóxica, durante su manejo deben emplearse guantes,
lentes de protección y lavarse las manos inmediatamente después de usarla!
B.13.4.3
Medio de Cloruro de litio feniletanol -moxolactam (LMP)
|
Ingredientes |
Cantidad |
|
Agar
fenil etanol |
|
|
Glicina
anhídra |
|
|
Cloruro
de litio |
|
|
Solución
de moxolactam al 1 % en amortiguador de fosfatos pH 6,0 |
2,0 mL |
|
Agua
|
1000,0 mL |
Esterilizar el medio (sin moxolactam) en
autoclave a 121 ±
B.13.4.4
Medio Oxford
B.13.4.4.1
Medio Base Oxford (OXA)
|
Ingredientes |
Cantidad |
|
Base de agar Columbia |
|
|
Esculina |
|
|
Citrato férrico amónico |
|
|
Cloruro de litio |
|
|
Agua |
1000,0 mL |
Agregar los ingredientes a un litro de agua y
llevar a ebullición hasta disolución completa. Esterilizar en autoclave a 121 ±
Un litro de medio Oxford debe contener los
siguientes suplementos:
|
Suplementos |
Cantidad |
|
Cicloheximida |
400 mg |
|
Sulfato de colistina |
20 mg |
|
Acriflavina |
5 mg |
|
Cefotetán |
2 mg |
|
Fosfomicina |
10 mg |
Disolver la cicloheximida, el sulfato de
colestina, acriflavina, cefotetán y la fosfomicina en 10 mL de una mezcla 1:1
de etanol: agua. Esterilizar por filtración antes de agregar al medio base.
Mezclar y vaciar en cajas Petri estériles. Las placas del medio Oxford se
pueden almacenar como máximo dos semanas.
B.13.4.5
Agar Soya tripticaseína con 0,6% de extracto de levadura (ASTEL)
|
Ingredientes |
Cantidad |
|
Agar soya tripticaseína |
|
|
Extracto de levadura |
|
|
Agua |
1000,0 mL |
Agitar y calentar a ebullición hasta disolver
el agar. Esterilizar a 121 ±
B.13.4.6
Agar Sangre de carnero
|
Ingredientes |
Cantidad |
|
Base de agar sangre |
95,0 mL |
|
Sangre de carnero desfibrinada |
5,0 mL |
Preparar el agar base de acuerdo a las
instrucciones del fabricante. Enfriar a 45 ±
B.13.4.7
Caldo Nitratos
|
Ingredientes |
Cantidad |
|
Nitrato de potasio |
|
|
Cloruro de sodio |
|
|
Peptona |
|
|
Agua |
1000,0 mL |
Agregar los ingredientes a un litro de agua,
agitar hasta disolución completa. Verter en tubos de 13 x
B.13.4.8
Medios para
B.13.4.8.1
Medio de SIM
|
Ingredientes |
Cantidad |
|
Peptona de caseína |
|
|
Peptona de carne |
|
|
Sulfato de fierro y amonio |
|
|
Tiosulfato de sodio |
|
|
Agar |
|
|
Agua |
1000,0 mL |
Agitar y calentar a ebullición hasta disolver
el agar. Envasar en porciones de 4 mL en tubos de 13 x
B.13.4.8.2
Medio MTM
|
Ingredientes |
Cantidad |
|
Extracto de carne |
|
|
Peptona |
|
|
Cloruro de sodio (NaCl) |
|
|
Agar |
|
|
Agua |
1000,0 mL |
Agitar y calentar a ebullición hasta disolver
el agar. Envasar en porciones de 4 mL en tubos de 13 x
B.13.4.9
Caldo Púrpura para fermentación de carbohidratos
|
Ingredientes |
Cantidad |
|
Proteosa peptona No. 3 |
|
|
Cloruro de sodio |
|
|
Extracto de carne |
|
|
Púrpura de bromocresol |
|
|
Agua |
1000,00 mL |
Calentar si es necesario para disolver los
ingredientes. Esterilizar en autoclave durante 15 min. A 121 ±
Nota:
Los sistemas bioquímicos
comerciales validados pueden usarse como alternativa para las pruebas
bioquímicas convencionales.
B.13.5
Preparación de
Para la preparación de la muestra seguir con
lo establecido en el numeral 9 de este apéndice.
B.13.6
Procedimiento
Este método debe realizarlo un microbiólogo
experimentado, en un ambiente controlado, aislado de áreas de producción de
alimentos. Se debe tener especial cuidado en la disposición de aquellos
materiales y equipo que hayan estado en contacto con alimentos sospechosos,
antes de desecharlos o volver a utilizarlos. Esta técnica por ningún motivo
debe aplicarla personal inmunocomprometido ya sea por enfermedad o por el uso
de medicamentos, mujeres embarazadas o personas de edad avanzada.
B.13.6.1
Procedimiento de Enriquecimiento
Tomar una muestra representativa del
alimento, tanto de la superficie externa como del interior Colocar 25 mL o
B.13.6.1.1
Aislamiento
Después de 24 y 48 h de incubación en el
medio EB, resembrar en los medios LMP y OXA. Incubar las placas del medio LMP a
B.13.6.2
Identificación
Se deben utilizar cepas de referencia
positivas y negativas para cada una de las pruebas. Seleccionar colonias
típicas y sembrar en medio ASTEL. Incubar a
B.13.6.2.1
Prueba de Movilidad en Fresco
Hacer preparaciones en fresco (en gota
suspendida o entre porta y cubreobjetos) utilizando solución salina al 0,85%.
La suspensión debe ser densa y emulsificarse completamente, y observar con
objetivo de inmersión en un microscopio de contraste de fase o microscopio de
campo oscuro. Las células de Listeria spp
son bacilos cortos con movilidad rotatoria o como si brincaran. Los bacilos
con movimientos rápidos no son Listeria
spp.
B.13.6.2.2
Prueba de Catalasa
Emulsificar un cultivo puro, con una gota de
solución de peróxido al 3%. La formación inmediata de burbujas indica que la
prueba es positiva. Las especies de Listeria
son catalasa positivo. Precauciones, la emulsión debe realizarse con un asa
de plástico o palillo de madera estéril evitando el contacto del metal con el
reactivo. Si las colonias provienen de agar base con sangre. Cualquier
contaminación de eritrocitos puede dar pruebas falsas positivas!
B.13.6.2.3
Tinción de Gram
Hacer una tinción de Gram de cultivos de
B.13.6.2.4
Prueba de Hemólisis
Dibujar una cuadrícula de
B.13.6.2.5
Prueba de Reducción de Nitratos
Inocular los tubos conteniendo caldo
nitratos, incubar a
B.13.6.2.6
Prueba de Movilidad en Agar
Inocular el medio SIM o MTM, incubar por 7
días a temperatura ambiente (20-
B.13.6.2.7
Prueba de Utilización de Carbohidratos
Inocular tubos de caldo púrpura para
fermentación de carbohidratos al 0,5 %: dextrosa, esculina, maltosa, ramnosa,
manitol y xilosa. Incubar 7 días a
B.13.6.2.8
Prueba de Cristie-Atkins -Munch-Peterson (CAMP)
Para la prueba de CAMP se emplean las
siguientes cepas de colección de S. aureus y R. equi:
|
Staphylococcus aureus |
Rhodococcus equi |
|
ATCC
49444 |
ATCC
6339 |
|
NCTC 7428 |
NCTC 1621 |
|
ATCC 25923 |
|
|
CIP 5710 |
|
Las cepas empleadas en la prueba de CAMP
pueden obtenerse de diversas colecciones nacionales e internacionales. En una
placa de agar sangre de carnero sembrar una estría de la cepa de S. aureus
y, paralelamente una de R. equi, separadas lo suficiente para que
entre éstas se puedan estriar perpendicularmente las cepas sospechosas de Listeria, sin que lleguen a tocarse
(aproximadamente
La hemólisis de L. monocytogenes y L. seeligeri
se incrementa cerca de la estría de S.
aureus, y la hemólisis de L. ivanovii
se aumenta cerca de la estría de R.
equi. Las especies restantes no son
hemolíticas en esta prueba.
Prueba
de CAMP para Listeria monocytogenes:
Diseño de la inoculación en placas de agar
sangre de carnero. Las líneas horizontales representan las estrías de la inoculación
de cinco cepas. Las líneas verticales representan las estrías de inoculación de
S. aureus (S) y R. equi (R). Las líneas sombreadas indican
el incremento de hemólisis en esas regiones.
Cuadro 1. Diferenciación de las
Especies de Listeria
|
Especies |
Hemolítico
(beta) a |
Reducción
nitratos |
Producción de
ácidos de |
CAMP |
|||
|
M |
R |
X |
S.a |
R.e |
|||
|
L. monocytogenes |
+ |
- |
- |
+ |
- |
+ |
- |
|
L. ivanovii |
+ |
- |
- |
- |
+ |
- |
+ |
|
L. innocua |
- |
- |
- |
bV |
- |
- |
- |
|
L. welshimeri |
- |
- |
- |
bV |
+ |
- |
- |
|
L. seeligeri |
+ |
- |
- |
- |
+ |
+1 |
- |
|
L. grayic |
- |
bV |
+ |
bV |
- |
- |
- |
a Sangre
de carnero desfibrinada
bV Variable
L. grayi incluye ahora las
cepas de la especie L. murrayi reductoras de nitratos y ramnosa
variable
M Manitol
R Ramnosa
X Xilosa
S.a Staphylococcus
aureus
R.e Rhodococcus
equi
1 Puede
haber reacciones débilmente positivas, particularmente a las 48 horas de
incubación.
B.13.6.3
Serología
La determinación de los tipos serológicos de Listeria se aplica cuando las
consideraciones epidemiológicas sean cruciales. Inocular en caldo de triptosa
por 24 h a
Cuadro 2. Serología de las
especies de Listeria
|
Especies |
Serotipo |
|
L. monocytogenes |
1/2A, 1/2B, 1/2C 3A, 3B, 4A, 4AB, 4B |
|
L. ivanovii |
5 |
|
L. innocua L .welshimeri |
4AB, 6A, 6B, Una 6A, 6B |
|
L.seeligeri |
1/2B, |
B.13.7
Expresión de Resultados
Comparar los resultados obtenidos con el
cuadro 1 y determinar el género y especie de las cepas aisladas. La
correspondencia de resultados con el cuadro anterior indica la presencia del
género Listeria.
El único miembro del género Listeria de importancia para esta norma
es Listeria monocytogenes.
B.13.8
Informe de
Cuando los resultados sean positivos para L. monocytogenes
informar la presencia en
B.14
Determinación de Vibrio cholerae
B.14.1
Material y Equipo
B.14.1.1
Licuadora y vasos de
licuadora estériles.
B.14.1.2
Frascos de vidrio de boca
ancha tipo tarro de 500 mL de capacidad con tapa de rosca.
B.14.1.3
Varilla de vidrio de 3mm de
diámetro y 20cm de largo, con un doblez terminal en ángulo recto de 4cm.
B.14.1.4
Balanza granataria de
B.14.1.5
Balanza analítica de
B.14.1.6
Incubadoras de 39-
B.14.1.7
Baño de agua de 42 ±
B.14.1.8
Cucharas estériles u otros
instrumentos apropiados para transferir muestras de alimentos.
B.14.1.9
Cajas Petri estériles de 15
x
B.14.1.10
Pipetas estériles de 1 mL
con graduación de 0,01mL, de 5 y 10 mL con graduación de 0,1mL.
B.14.1.11
Asas bacteriológicas de
B.14.1.12
Tubos de cultivo o de ensayo
de 16 x
B.14.1.13
Tubos para bioquímicas o
ensaye de 10 x
B.14.1.14
Tijeras y pinzas estériles.
B.14.115
Lámpara (para observar
reacciones serológicas).
B.14.1.16
Mecheros.
B.14.1.17
Papel pH (rango 1-14) con un
máximo de graduación de 0,4 unidades de pH por cambio de color.
B.14.1.18
Potenciómetro.
B.14.1.19
Bolsas de polietileno de 28
x
B.14.1.20
Aparato de filtración y
membranas de 0,45 micras.
B.14.2
Medios de Cultivo
B.14.2.1
Agua Peptonada Alcalina (APW)
FORMULA
|
Peptona |
|
|
Cloruro de sodio |
|
|
Agua destilada |
1 000 mL |
Disolver los ingredientes. Ajustar el pH de
tal forma que después de esterilizar éste sea de 8,5±0,2.Esterilizar en
autoclave 10 minutos a
B.14.2.2
Agar Tiosulfato, Citrato, Sales Biliares y Sacarosa (TCBS)
FORMULA
|
Extracto de levadura |
5g |
|
Proteosa peptona |
|
|
Sacarosa |
|
|
Tiosulfato de sodio.5H2O |
|
|
Citrato de sodio.2H2O |
|
|
Sales biliares |
|
|
Bilis de buey |
|
|
Cloruro de sodio |
|
|
Citrato férrico |
|
|
Azul de bromotimol |
40 mg |
|
Azul de timol |
40 mg |
|
Agar |
|
|
Agua destilada |
1 000 mL |
Preparar en un matraz por lo menos tres veces
más grande que el volumen requerido de medio. Adicionar los ingredientes en
agua destilada tibia y calentar con agitación constante hasta ebullición e
inmediatamente retirar del calor. No esterilizar. Enfriar a
B.14.2.3
Agar modificado con Celobiosa, Polimixina B y Colistina (mCPC)
Solución
1:
FORMULA
|
Peptona |
|
|
Extracto
de carne |
|
|
Cloruro
de sodio |
|
|
Solución
Stock de colorante1 000 |
1 mL |
|
Agar |
|
|
Agua
destilada |
900 mL |
Ajustar el pH a 7,6. Hierva hasta que se
disuelva el agar. Esterilizar por autoclave 15 minutos a
Solución
stock de colorantes 1 000 X:
FORMULA
|
Azul
de bromotimol |
|
|
Rojo
de cresol |
|
|
Etanol
al 95% |
100 mL |
Para obtener un color firme del medio usar
una solución colorante stock en lugar de estar pesando repetidamente los
colores en polvo. Disuelva el colorante en etanol hasta obtener una solución al
4% (peso/volumen). Agregue 1 mL de esta solución a cada litro de agar mCPC, la
cual tendrá al final 40 mg de azul de bromotimol y 40 mg de rojo cresol por
litro.
Solución
2:
FORMULA
|
Celobiosa |
|
|
Colistina |
400 000 UI |
|
Polimixina B |
100 000 UI |
|
Agua destilada |
100 mL |
Disuelva la celobiosa por calentamiento en
agua destilada. Enfríe y agregue los antibióticos. Esterilice por filtración,
agregue la solución
B.14.2.4
Agar T1N1 (Agar Triptona y Sal)
FORMULA
|
Triptona o tripticasa |
|
|
Cloruro de sodio |
|
|
Agar |
|
|
Agua destilada mL |
1 000 |
Suspenda los ingredientes y hierva hasta
disolución del agar, si lo desea inclinado, distribuya en tubos. Esterilice en
autoclave 15 minutos a
B.14.2.5
Agar Gelatina (GA)
FORMULA
|
Peptona |
|
|
Extracto de levadura |
|
|
Gelatina |
|
|
Agar |
|
|
Agua destilada |
1000 mL |
Suspenda los ingredientes y hierva hasta
disolución de la gelatina y el agar, ajuste el pH a 7,2 ± 0.2. Esterilice en
autoclave 15 minutos a
B.14.2.6
Agar Gelatina con Sal (GS)
Preparar agar gelatina (GA), pero adicionando
B.14.2.7
Caldo Glucosa de Hugh-Leifson
FORMULA
|
Peptona |
|
|
Extracto de levadura |
|
|
Cloruro de sodio |
|
|
Dextrosa |
|
|
Púrpura de bromocresol |
|
|
Agar |
|
|
Agua destilada |
1 000 mL |
Suspenda los ingredientes y hierva hasta
disolver el agar. Ajuste el pH a 7,4 ± 0,2. Coloque en tubos y esterilice en
autoclave 15 minutos a
B.14.2.8
Medio Base de Descarboxilasa (Arginina, Lisina y Ornitina)
FORMULA
BASE
|
Peptona |
|
|
Extracto
de levadura |
|
|
Dextrosa
(D-glucosa) |
|
|
Púrpura
de bromocresol |
|
|
Agua
destilada |
1 000 mL |
Para caldo de arginina, lisina y ornitina,
adicione
B.14.2.9
Caldo Triptona y
Caldos Triptona Sal T1N0,T1N1,T1N3, T1N6,T1N8 y T1N10
FORMULA
|
Triptona o tripticasa |
|
|
Cloruro de sodio |
0,10,30,60,80 o |
|
Agua destilada |
1 000 mL |
Disuelva los ingredientes en agua destilada,
para T1N0 no agregue cloruro de sodio, para T1N1 use 10g de cloruro de sodio
(1% w/v concentración de cloruro de sodio); así respectivamente. Para T1N3 usar
30g de NaCl por litro (3% w/v concentración de cloruro de sodio). Distribuya en
tubos de tapón de rosca de 16 x
B.14.2.10
Caldo Soya Tripticasa (TSB)
FORMULA
|
Peptona de tripticasa (Triptona) |
|
|
Peptona de fitona (Soytona) |
|
|
Cloruro de sodio |
|
|
Fosfato dipotásico |
|
|
Dextrosa |
|
|
Agua destilada |
1 000 mL |
Suspenda los ingredientes en agua destilada y
caliente hasta disolución. Distribuya 225 mLen matraces de 500 mL o tubos.
Esterilice en autoclave durante 15 minutos a
B.14.2.11
Agar Soya Tripticasa (TSA)
FORMULA
|
Peptona tripticasa (Triptona) |
|
|
Peptona de fitona (Soytona) |
|
|
Cloruro de sodio |
|
|
Agar |
|
|
Agua destilada |
1 000 mL |
Suspenda los ingredientes en agua destilada y
hierva durante un minuto hasta disolución del agar. Para Vibrio spp
halofílicos, agregar
B.14.2.12
Agar de Hierro Kligler (KIA)
FORMULA
|
Peptona polipeptona |
|
|
Lactosa |
|
|
Dextrosa |
|
|
Cloruro de sodio |
|
|
Citrato férrico amoniacal |
|
|
Tiosulfato de sodio |
|
|
Rojo de fenol |
|
|
Agar |
|
|
Agua destilada |
1 000 mL |
Suspender los ingredientes y hervir hasta
disolución del agar. Distribuir en tubos de tapón de rosca. Esterilizar en
autoclave durante 15 minutos a
B.14.2.13
Agar Arginina Glucosa Inclinado (AGS)
FORMULA
|
Peptona |
|
|
Extracto de levadura |
|
|
Triptona |
|
|
Cloruro de sodio |
|
|
Glucosa |
|
|
L-Arginina(hidrocloruro) |
|
|
Citrato férrico amónico |
|
|
Tiosulfato de sodio |
|
|
Púrpura de bromocresol |
|
|
Agar |
|
|
Agua destilada |
1 000 mL |
Suspender los ingredientes en agua destilada,
hervir hasta disolución del agar, y distribuir en cantidades de 5 mL a tubos de
13 x
B.14.2.14
Agar Triple Azúcar y Hierro (TSI)
FORMULA
|
Polipeptona |
|
|
Cloruro de sodio |
|
|
Lactosa |
|
|
Sacarosa |
|
|
Glucosa |
|
|
Sulfato ferroso amónico |
|
|
Tiosulfato de sodio |
|
|
Rojo de fenol |
|
|
Agar |
|
|
Agua destilada |
1 000 mL |
Disolver los ingredientes en agua destilada.
Mezclar bien y calentar a ebullición, agitando ocasionalmente hasta completa
disolución. Enfriar a
B.14.2.15
Agar de Hierro y Lisina (LIA)
FORMULA
|
Peptona o gelisato |
|
|
Extracto de levadura |
|
|
Glucosa |
|
|
L-Lisina |
|
|
Citrato férrico amónico |
|
|
Tiosulfato de sodio |
|
|
Púrpura de bromocresol |
|
|
Agar |
|
|
Agua destilada |
1 000 mL |
Disolver los ingredientes en el agua
destilada y mezclar bien; calentar hasta ebullición con agitación frecuente
hasta conseguir la disolución completa. Esterilizar en autoclave 12 minutos a
B.14.2.16
Caldo Rojo de Metilo y Vogues Proskauer(RM-VP)
FORMULA
|
Peptona |
|
|
Glucosa |
|
|
Fosfato dipotásico |
|
|
Agua destilada |
1 000 mL |
Disolver los ingredientes en 800 mL de agua
tibia. Para Vibrio spp halofílicos,
agregar
B.14.2.17
Medio para Prueba de Movilidad (semisólida)
FORMULA
|
Peptona |
|
|
Extracto de carne |
|
|
Cloruro de sodio |
|
|
Agar |
|
|
Agua destilada |
1 000 mL |
Calentar con agitación y hervir de
B.14.3
Soluciones y Reactivos
B.14.3.1
Prueba de rojo de metilo.
Reactivo
FORMULA
|
Rojo de metilo |
|
|
Alcohol etílico |
300 mL |
|
Agua destilada |
200 mL |
Disolver el rojo de metilo en el alcohol y
diluir con el agua destilada, para llevar a cabo la prueba, añadir 5 gotas de
la solución a 5 mL del cultivo problema. Resultados: Un color rojo demuestra un
pH menor a 4,5 y la prueba es Positiva. Un color amarillo se reporta como
prueba Negativa.
B.14.3.2
Prueba de Vogues-Proskauer.
Esta prueba es para comprobar la presencia
del diacetilo.
Reactivo
FORMULA
|
Alfa naftol |
|
|
Alcohol etílico absoluto |
100 mL |
Añadir 0,6 mL de la solución de alfa naftol y
0,2 mL de una solución acuosa al 40% de KOH a 1 mL de cultivo. Resultados: El
desarrollo de una coloración roja en 15 minutos constituye una reacción
Positiva.
B.14.3.3
Prueba de oxidasa.
Reactivo
FORMULA
|
N,N,N,N-Tetrametil-p-Fenilendiamino |
|
|
Agua destilada |
100 mL |
Conservar en frasco oscuro a 5-
B.14.3.4
Reacción de indol.
Reactivo
de Kovac
FORMULA
|
P-dimetilaminobenzaldehído |
|
|
Alcohol amílico o alcohol isoamílico |
750 mL |
|
Acido clorhídrico concentrado |
25 mL |
Disolver el p-dimetilaminobenzaldehído en el
alcohol amílico y agregar el ácido clorhídrico lentamente, gota a gota y
agitando. Debe conservarse en frasco ámbar con tapón esmerilado; el color del
reactivo va del amarillo al café claro. Se debe conservar a
B.14.4
Procedimiento
Sembrar un tubo con 5 mL de caldo triptona.
Incubar 48 horas a
B.14.4.1
Preparación de
Para la preparación de la muestra seguir con
lo establecido en el numeral 9 de este apéndice.
Para helados o bases o mezclas para helados y
para los quesos, se deben preparar las siguientes diluciones 10-1, 10-2, 10-3, 10-4, 10-5 y 10-6. Tomar
B.14.4.2
Resembrar
Después de la incubación, y sin agitar,
transferir el inóculo de la película (crecimiento superficial) con un asa de 3-
B.14.5
Morfología Colonial.
Examinar las placas a fin de determinar si se
presentan las características coloniales que a continuación se describen,
seleccionar por lo menos 3 colonias sospechosas de cada placa y aplicarlas con
estría cruzada para aislar en agar T1N1 o en agar soya tripticasa con sal (al
2% de concentración de NaCl) e incubar durante 12-18 horas a 35-
a.-
Agar TCBS.
Las colonias de V. cholerae (El Tor y Clásico) son grandes, lisas, amarillas
(positivas para la fermentación de la sacarosa) y ligeramente achatadas, con el
centro opaco y los bordes translúcidos.
Nota:
Las especies de vibrio no
producen colonias pequeñas de color crema en agar TCBS. Las colonias de V. mimicus, que están estrechamente
relacionadas con la especie anterior, son verdes (sacarosa negativas). La
mayoría de las demás especies de vibrio crecen en agar TCBS y producen colonias
amarillas y verdes.
b.-
Agar mCPC.
Las colonias de V. cholerae El Tor son púrpuras (negativas para la fermentación de
la celobiosa). El V. vulnificus
produce colonias amarillas achatadas, con el centro opaco y los bordes
translúcidos. La mayoría de las demás especies de Vibrio spp. no crecen fácilmente en agar mCPC.
B.14.6
Diferenciación.
Diferenciación de los vibrios sospechosos de
los microorganismos que no son vibrios.
a.- TSI,KIA y agar inclinado de Arginina y
Glucosa (AGS).
Inocular las colonias individuales en medios
de cultivo TSI (Agar de Triple Azúcar y Hierro), KIA (Agar de Hierro Kliger) y
AGS, picar y estriar en el agar inclinado. Incubar los tubos inoculados, con el
tapón no muy apretado, durante
b.- Caldo triptona al 3% de NaCl (T1N3).
Inocular las colonias en los caldos T1N0 y
T1N3 e incubar durante
c.-
Caldo glucosa de Hugh-Leifson.
Inocular colonias individuales en tubos
duplicados con caldo de glucosa de Hugh-Leifson. Recubrir un tubo con una capa
de aceite mineral estéril o vapor líquido (50% de petrolato y 50% de parafina)
unos dos centímetros de grueso. Incubar ambos tubos durante
d.- Prueba de Oxidasa.
Realizar la prueba de oxidasa con cultivos
puros de agar soya tripticasa (2% de NaCl) u otro medio que no contenga
carbohidratos fermentables. Un método fácil consiste en colocar un círculo de
papel filtro en una caja de Petri y humedecerlo con algunas gotas de reactivo
de oxidasa. Con un palito aplicador de madera, un mondadientes o una asa de
platino estéril, sacar un poco de cultivo de la placa y tocar el papel
humedecido, si hay microorganismos oxidasa positivos, el papel se tornará
púrpura oscura o azul en pocos segundos. Las especies patógenas de Vibrio spp. son oxidasa positivas
(excepto el V. metschnnikovii).
B.14.7
Identificación y Confirmación de V.chloreae
01, V.cholerae NO 01 y V. mimicus.
a.-
Leer los resultados de las prueba bioquímicas de TSI, KIA, AGS, T1N0 y T1N3 o
GA y GS, y caldo glucosa de Hugh-Leifson.
b.-
Hacer una tinción de Gram a un cultivo de
Nota:
Los cultivos puros que se
someterán a las demás pruebas serológicas y bioquímicas para el V. cholerae son sacarosa positivos
(amarillo) en agar TCBS y sacarosa negativos (verdes) en el caso de V. mimicus o son celobiosa negativos
(verde-púrpura) en agar mCPC, crecen en caldo T1N0 o en placas con GA;
presentan reacciones características en TSI, KIA y AGS. Son gelatina y oxidasa
positivos, son bacilos curvos gram negativos y producen ácido a partir de la
glucosa, tanto en la oxidación como en la fermentación, en el caldo de cultivo
de Hugh-Leifson.
c.-
Pruebas Bioquímicas.
Las reacciones bioquímicas para
identificación de V. cholerae y otras
especies bacterianas afines figuran en el cuadro anexo. La fórmula para todos
los medios bioquímicos deberá contener por lo menos un 2% de NaCl. En vez de
medios convencionales se pueden usar tiras AP120E, con 2% de NaCl como
diluyente. Para el V. cholerae se
puede usar solución salina fisiológica (0,85% de NaCl) como diluyente.
d.-
Prueba Serológica de Aglutinación.
Usar antisuero de diagnóstico del grupo 01 y
del subgrupo Inaba (factores AC) y Ogawa (Factores AB) para el antígeno del
serotipo 01. Usar cultivos de
Como es posible que los antígenos de los
antisueros estén relacionados entre sí, hay que realizar pruebas bioquímicas
para confirmar que el cultivo puro sea de V.
cholerae 01 o No. 01.
Nota:
Anticuerpos monoclonales
están disponibles, pero el anti-B y anti-C reaccionan opuestamente con
bacterias de otras especies. Uso de anticuerpos policlonales y/o monoclonales
será para el antígeno del complejo 01
1.-
Los cultivos que aglutinan
con el antisuero del grupo 01, pero no en solución salina fisiológica simple,
son de V. cholerae del grupo 01 si
las reacciones bioquímicas confirman que el cultivo puro es de V. cholerae. Los cultivos que se
aglutinan con este antisuero para grupos específicos pueden ser clasificados
según el subtipo con anticuerpos Inaba y Ogawa.
- Los cultivos que aglutinan con el suero
polivalente (grupo 01) y con los antisueros Inaba y Ogawa, tienen los 3
factores (A, B y C) y son del serotipo Hikojima.
- Los cultivos que aglutinan con el antisuero
polivalente, pero no aglutinan con antisueros Inaba y Ogawa, no se pueden
tipificar con estos antisueros.
2.-
Los cultivos de V. cholerae cuya identidad se haya
confirmado con métodos bioquímicos y que no aglutinen con el antisuero del
grupo 01 son V. cholerae 0:1. El
suero para la clasificación de V.
cholerae No 0:1 según el tipo se puede obtener de R.J. Siebeling.
3.-
Los cultivos que se
aglutinan en el antisuero del grupo 01 y en solución salina, no se pueden
clasificar según el tipo. Sin embargo, si se usa un medio más rico, como en TSA
o agar infusión cerebro corazón (BHI), se puede eliminar esta autoaglutinación.
e.
Características mínimas para la identificación de V. cholerae.
Las características que permiten suponer la
presencia de V. cholerae como mínimo
son las siguientes:
1.-
Morfología.
Bacilo o bacilo encorvado, no esporogénico y
gram negativo.
2.-
Aspecto en TSI.
Estría ácido, picadura ácido, gas negativo y
H2S negativo.
3.-
Prueba de Hugh-Leifson.
Fermentación de la glucosa y oxidación
positiva.
4.-
Citocromo-oxidasa positivo.
5.-
Prueba de la dihidrolasa
arginina: negativo.
6.-
Prueba de la
lisinadescarboxilasa: positivo.
7.-
Prueba de VP: Positivo El
Tor, negativo Clásico y V. mimicus.
8.-
Crecimiento a 42ºC:
positivo.
9.-
Prueba de halofilia con
NaCl.
0%: positivo, 3%: positivo, 6%: usualmente
negativo. Algunas cepas de V. cholerae
NO 01 se desarrollan a 0% de NaCl.
10.-
Fermentación de la sacarosa:
positivo para V. cholerae (negativo
para V. mimicus).
11.-
Prueba de ONPG: positivo.
12.-
Fermentación de la
arabinosa: negativo.
13.-
0/129 sensitiva: sensible
para 10 y 150 µg 0/129
B.14.8
Reacciones
REACCIONES DE ALGUNOS Vibrio
spp. EN AGAR KIA, TSI Y AGS.
|
Microorganismos |
KIA |
TSI |
AGS |
|||
|
Estría |
Picadura |
Estría |
Picadura |
Estría |
Picadura |
|
|
V.cholerae |
K |
A |
A(K)* |
A |
K |
a |
|
V.mimicus |
K |
A |
K(A)* |
A |
K |
A |
|
V.parahaemolyticus |
K |
A |
K |
A |
K |
A |
|
V.alginolyticus |
K |
A |
A |
A |
K |
A |
|
V.vulnificus |
K o A |
A |
K(A)* |
A |
K |
A |
|
Aeromonas .hidrophyla |
K o A |
A |
K o A |
A |
K |
K |
|
Plesiomonas shigelloides |
K o A |
A |
K o A |
A |
N |
N |
* = Raramente
K = Alcalino
A = Acido
a = Ligeramente ácido
N = Neutro
Ninguna de las especies enumeradas produce
sulfuro de hidrógeno en medios KIA, TSI o AGS, ni una cantidad perceptible de
gas a partir de glucosa en medios KIA, TSI o AGS. Algunas especies de Aeromonas spp. Pueden producir gas a
partir de glucosa en estos medios.
B.15
Determinación de Enterotoxina Estafilocóccica, por el método de Elisa.
B.15.1
Principio del Método.
Este método se basa en un inmunoensayo visual
el cual proporciona una prueba rápida (4 h), sensible (1,0 ng o más por mL o
g), y específica para la identificación de las enterotoxinas A-E
estafilocóccicas. Sin embargo, con esta prueba no se identifican los serotipos
de enterotoxina, en forma individual. La prueba de Elisa se realiza en
configuración de “sandwich”.
B.15.2
Materiales y Equipo
B.15.2.1
Algodón absorbente.
B.15.2.2
Micropipetas de 50-200 L y 5-20 L.
B.15.2.3
Puntas de plástico para
micropipeta.
B.15.2.4
Plástico para envolver o
sellar recipientes de plástico.
B.15.2.5
Papel pH (intervalo 0-14).
B.15.2.6
Frascos de plástico de 500
mL.
B.15.2.7
Jeringas de plástico de 25 mL.
B.15.2.8
Tubos para centrífuga.
B.15.2.9
Tubos de polipropileno de 12
x
B.15.2.10
Polietilen glicol (PEG, peso
molecular de 15,000-20,000).
B.15.2.11
Tubo de diálisis
(12,000-14,000 peso molecular exclusión).
B.15.2.12
Vasos de precipitados de 250
mL.
B.15.2.13
Filtros tipo jeringa (para filtrar los alimentos). Preparar
jeringas de plástico desechables (0,25 mL) e insertar suficiente cantidad de
algodón absorbente, para hacer un empaque de
B.15.2.14
Placa de 48 o 96 pozos
recubiertos con el grupo de antisueros *.
B.15.2.15
Soporte para sostener la
placa *.
B.15.2.16
Instructivo del método *.
B.15.2.17
Comparador de color *.
B.15.2.18
Hoja de resultados *.
B.15.2.19
Materiales suministrados por
el fabricante.
B.15.2.20
Equipo TECRATM.
B.15.2.21
Incubadora a 35-
B.15.2.22
Omnimixer, licuadora (o
equivalente) para la preparación de los extractos de alimentos.
B.15.2.23
Centrífuga a 1000 -3000 x g.
B.15.2.24
Agitador de microplacas (opcional).
B.15.2.25
Lector de microplacas
(opcional).
B.15.2.26
Balanza.
B.15.3
Reactivos.
Los reactivos que a continuación se mencionan
deben ser grado analítico a menos que se indique otra especificación y por agua
debe entenderse agua destilada.
B.15.3.1
Solución amortiguadora Tris
B.15.3.2
Solución de hidróxido de
sodio 1,0 N (NaOH).
B.15.3.3 Acido clorhídrico (HCl).
B.15.3.4 Agua destilada o deionizada.
B.15.3.5 Hipoclorito de sodio.
B.15.3.6 BHI con 0,7% de agar (m/v).
B.15.3.7 Solución de lavado. Contiene:
B.15.3.8 Aditivo para la muestra. Es una solución que
contiene:
B.15.3.9 Control positivo: Diluir 25 L de control positivo concentrado (toxina estafilocóccica tipo B,
B.15.3.10 Control negativo. Contiene:
B.15.3.11 Diluyente del Conjugado. Contiene:
B.15.3.12 Conjugado liofilizado. Un frasco que
contiene antisuero polivalente (A-E) liofilizado, conjugado; 0,003g de Na2B4O7,
B.15.3.13 Diluyente del Substrato. Cada 26 mL de H2O contienen
B.15.3.14 Substrato. Un frasco de liofilizado que contiene;
B.15.3.15 Solución para detener la reacción (solución
stop). Cada 6,0 mL contienen;
* Reactivos suministrados por el fabricante
B.15.4 Procedimiento.
B.15.4.1
Preparación de las Muestras.
B.15.4.1.1
Productos Fluidos y Productos Deshidratados.
Pesar
B.15.4.1.2
Ingredientes Deshidratados.
Agregar 125 mL de solución Tris
B.15.4.1.3
Quesos.
Agregar 50 mL de agua a
B.15.4.1.4
Otros Alimentos.
Agregar 50 mL de solución Tris
Nota
1: Preparar los extractos de
alimentos inmediatamente antes de realizar la prueba.
Precauciones
Generales:
En caso de alimentos crudos fermentados,
procesados o enlatados, con evidentes defectos; o de cultivos fluidos obtenidos
en el laboratorio, que pudieran dar como resultado el crecimiento de
microorganismos productores de peroxidasa, es necesario, antes de hacer la
determinación de toxina, verificar si los extractos de alimentos o preparados a
partir del cultivo en el laboratorio, contienen peroxidasa, debido a que esta
enzima podría interferir con la interpretación de los resultados.
Para determinar la presencia de peroxidasa,
agregar 50 L del substrato (B.15.3.14.), en una placa de microtitulación sin
tratar (no contiene anticuerpos para la enterotoxina estafilocóccica). Dejar en
reposo 10 min. Si el color cambia a azul o azulverdoso, indica que la muestra
contiene peroxidasa intrínseca; la cual debe inactivarse. Si la muestra
permanece incolora (o con el color original), realizar el análisis de
enterotoxina. Para inactivar la peroxidasa intrínseca, preparar una solución al
30% (m/v) de azida de sodio y agregar 1 mL de esta solución a 4 mL de muestra
(la concentración final de la azida de sodio es de 6% (m/v). Mezclar y agregar
un poco de aditivo (B.15.3.8), dejar
en reposo 1-2 min a temperatura del laboratorio (20-
Nota
2: Para alimentos crudos
(ejemplo: verduras), seguir las precauciones generales señaladas anteriormente.
B.15.4.2
Preparación de Reactivos.
B.15.4.2.1
Reconstitución de
Diluir, en un frasco de reactivos la solución
concentrada (como lo indique el fabricante), con agua destilada o deionizada,
para obtener
B.15.4.2.2
Preparación del Conjugado.
Agregar el diluyente del conjugado y
rehidratar a temperatura del laboratorio. Mezclar suavemente. Esta preparación es el "Conjugado
reconstituido".
B.15.4.2.3
Preparación del Substrato.
Disolver el substrato con el diluyente
(B.15.3.13), asegurarse que el contenido se haya disuelto completamente. Dejar
a la temperatura del laboratorio (20-
B.
15.4.2.4 Precauciones generales:
Observar la fecha de caducidad del equipo adquirido. Es la última
fecha en la cual el producto debe utilizarse. Preparar todos los reactivos con
cuidado y anotar la fecha de reconstitución, en la etiqueta externa de la caja.
Usar los reactivos dentro de los 65 días a la fecha anotada en la etiqueta.
Refrigerar todos los componentes (2-
El equipo de inmunoensayo visual está preparado para utilizarse como
una unidad integral; por tanto, no se deben mezclar los componentes de
diferentes lotes.
Utilizar puntas nuevas para cada muestra de alimento. Evitar la
contaminación cruzada al llenar los pozos. Si se usan propipetas de plástico
para distribuir el conjugado y el substrato, se deben mantener siempre por
separado. Asegurarse de no confundir las tapas de los reactivos.
Usar controles positivos y negativos en cada prueba.
Preparar recipientes con solución al 2% de hipoclorito de sodio para
desechar todas las muestras y materiales que contengan toxina.
Mantener los pozos removibles que no se usen dentro del paquete y
volver a sellar con cinta, después de cada uso.
B.15.4.3
Determinación de
B.15.4.3.1
Preparación de los pozos.
Tomar del paquete el número necesario de
pozos; uno para cada muestra, uno para control positivo y uno para control
negativo. Si se requiere, pueden utilizarse pozos adicionales (control positivo
y negativo en alimento).
B.15.4.3.2
Prelavado.
Con la ayuda de una pizeta llenar cada pozo
con solución de lavado y dejar en reposo durante 10 minutos a la temperatura de
laboratorio (20-
B.15.4.3.3
Colocación de las Muestras.
Pasar alícuotas de 200 L de los controles y muestras (extractos de alimento o de cultivos)
dentro de pozos individuales. Registrar la posición de cada muestra en la hoja
de registro específica. Golpear suavemente la placa para asegurarse de la
distribución homogénea y del contacto de las muestras con las paredes de los
pozos; el uso de un agitador de microplacas durante 30 segundos, es opcional.
Cubrir los pozos con una película plástica, estirable, autoadherible o sello
especial de microplacas; para evitar la evaporación. Incubar 2 hrs. a 35-
B.15.4.3.4
Segundo Lavado.
Presionar firmemente los pozos en la placa e
invertir rápidamente. Vaciar el contenido de los pozos en el recipiente de
desecho (con hipoclorito de sodio al 2%). Eliminar el residuo de líquido
golpeando enérgicamente, varias veces la placa invertida, sobre una toalla de
papel absorbente; llenar completamente los pozos con solución de lavado, y
repetir el lavado en la misma forma, de
Nota
3: El lavado profundo de los
pozos es un paso crítico y asegurará una clara interpretación de los
resultados.
B.15.4.3.5
Adición de Conjugado.
Agregar 200 L del conjugado reconstituido (enzima) a cada pozo. Volver a cubrir la
placa e incubar 1 h a temperatura de laboratorio (20-
B.15.4.3.6
Adición del Substrato.
Agregar, a cada pozo, 200 L del substrato reconstituido. Dejar a temperatura del laboratorio (20-
B.15.4.3.7
Determinar los Resultados visualmente o mediante un Lector de Microtitulación.
B.15.5
Interpretación de los Resultados:
B.15.5.1 Colocar la placa que sostiene los pozos
sobre un fondo blanco. Comparar el color de cada pozo con el comparador de
color. El control positivo de toxina (y el control positivo de alimento, si se
usó) deben dar un color verde intenso, lo que indica que todos los reactivos
han funcionado. Si el control negativo es significativamente más oscuro que el
representado en comparador de color, significa que hubo, probablemente, un
lavado inadecuado y la prueba debe repetirse.
B.15.5.2
La muestra se considera positiva, si cumple los siguientes
criterios:
El control negativo está dentro del intervalo de color negativo, representado
en el comparador de color, y
Las muestras presentan un color verde o azul más oscuro que el
intervalo negativo representado en el comparador de color.
B.15.5.3
La prueba de enterotoxina se
considera negativa, si se cumplen
los siguientes criterios:
El control negativo está dentro del intervalo de color negativo,
representado en el comparador de color, y
La muestra es incolora o tiene el color dentro del intervalo negativo,
representado en el comparador de color.
B.15.6
Expresión de Resultados.
|
Prueba positiva o negativa para enterotoxina
estafilocóccica |
Cuando se obtengan resultados positivos,
éstos tendrán que ser confirmados por el método de doble difusión en gel en
laminilla, establecido en el numeral 11
de este apéndice.
B.16.
Método para
B.16.1
Introducción
Cuando se requiere investigar el contenido de
microorganismos viables en un alimento, la técnica comúnmente utilizada es la
cuenta en placa. En realidad esta técnica no pretende poner en evidencia todos
los microorganismos presentes. La variedad de especies y tipos diferenciables
por sus necesidades nutricionales, temperatura requerida para su crecimiento,
oxígeno disponible, etc., hacen que el número de colonias contadas constituyan
una estimación de la cifra realmente presente y la misma refleja si el manejo
sanitario del producto ha sido el adecuado.
Por otra parte el recuento de termofílicos, psicrofílicos
y psicotróficos es importante para predecir la estabilidad del producto bajo
diferentes condiciones de almacenamiento.
Para obtener resultados reproducibles y por
lo tanto significativos, es de suma importancia seguir fielmente y controlar
cuidadosamente las condiciones.
Esta técnica puede aplicarse para la
estimación de microorganismos viables en una amplia variedad de alimentos.
B.16.2
Fundamento
El fundamento de la técnica consiste en
contar las colonias, que se desarrollan en el medio de elección después de un
cierto tiempo y temperatura de incubación, presuponiendo que cada colonia
proviene de un microorganismo de la muestra bajo estudio. El método admite
numerosas fuentes de variación, algunas de ellas controlables, pero sujetas a
la influencia de varios factores.
B.16.3
Reactivos
Los reactivos que a continuación se
mencionan, deben ser grado analítico.
Cuando se indique agua, debe entenderse agua
destilada, con pH cercano a la neutralidad.
B.16.4
Medio de Cultivo.
B.16.4.1
Agar Triptona-Extracto de Levadura (agar para cuenta estándar).
|
Fórmula |
|
|
Ingredientes |
Cantidades |
|
Extracto de levadura |
|
|
Triptona |
|
|
Dextrosa |
|
|
Agar |
|
|
Agua |
|
Preparación
del Medio de Cultivo.
Suspender los componentes del medio
deshidratado en un litro de agua. Hervir hasta total disolución.
Distribuir en recipientes de vidrio
esterilizables de capacidad no mayor de 500 mL, cantidades de aproximadamente
la mitad del volumen del mismo. Esterilizar en autoclave a 121 ± 1,0ºC, durante
15 minutos. El pH final del medio debe ser 7,0 ±
Si el medio de cultivo es utilizado
inmediatamente, enfriar a
En caso de medios deshidratados seguir las
instrucciones del fabricante.
El medio de cultivo anterior es el de uso más
generalizado. Para algunos alimentos en particular se requerirá de un medio de
cultivo especial que se debe indicar al describir la técnica para ese alimento.
B.16.5
Materiales
Todo el material que tenga contacto con las
muestras o los microorganismos debe estar estéril.
Se requiere, los materiales mencionados
numeral 9, Preparación y Dilución de Muestras de Alimentos para su Análisis
Microbiológico.
B.16.6
Aparatos e Instrumentos
B.16.6.1 Incubadora con termostato que evite
variaciones mayores de ± 1,0ºC, provista con termómetro calibrado.
B.16.6.2 Contador de colonias de campo
obscuro, con luz adecuada, placa de cristal cuadrículada y lente amplificador.
B.16.6.3 Registrador mecánico o electrónico.
B.16.6.4 Microscopio óptico.
B.16.6.5 Baño de agua con o sin circulación
mecánica, provista con termómetro calibrado con divisiones de hasta
B.16.7
Preparación de
Para la preparación de la muestra seguir
numeral 9, Preparación y dilución de muestras de alimentos para su análisis
microbiológico.
B.16.8
Procedimiento
B.16.8.1
Distribuir las cajas
estériles en la mesa de trabajo de manera que la inoculación; la adición de
medio de cultivo y homogenización, se puedan realizar cómoda y libremente.
Marcar las cajas en sus tapas con los datos pertinentes previamente a su
inoculación y correr por duplicado.
B.16.8.2
Después de inocular las
diluciones de las muestras preparadas según en B.5.1 Preparación y dilución de
muestras de alimentos para su análisis microbiológico, en las cajas Petri,
agregar de
B.16.8.3
Incluir una caja sin inóculo
por cada lote de medio y diluyente preparado como testigo de esterilidad.
B.16.8.4
El tiempo transcurrido desde
el momento en que la muestra se incorpora al diluyente hasta que finalmente se
adiciona el medio de cultivo a las cajas, no debe exceder de 20 minutos.
B.16.8.5
Incubar las cajas en
posición invertida (la tapa hacia abajo) por el tiempo y la temperatura que se
requieran, según el tipo de alimento y microorganismo de que se trate, véase el
cuadro 1.
CUADRO 1
|
Grupo bacteriano |
Temperatura |
Tiempo de incubación |
|
Termofílicos
aerobios |
55
± |
48
± 2 h |
|
Mesofílicos
aerobios |
35
± |
48
± 2 h |
|
Psicrotróficos |
20
± |
3
- 5 días |
|
Psicrofílicos
|
5
± |
7
- 10 días |
B.16.8.6
En la lectura seleccionar
aquellas placas donde aparezcan entre
B.16.8.7
Contar todas las colonias
desarrolladas en las placas seleccionadas (excepto las de mohos y levaduras),
incluyendo las colonias puntiformes. Hacer uso del microscopio para resolver los
casos en los que no se pueden distinguir las colonias de las pequeñas
partículas de alimento.
B.16.9
Expresión de Resultados
B.16.9.1
Cálculo del Método.
i) Después de la incubación, contar las placas
que se encuentren en el intervalo de
ii) Cuando dos diluciones están en el intervalo
apropiado, determinar la cuenta promedio dada por cada dilución antes de
promediar la cuenta de las dos diluciones para obtener la cuenta en placa por
gramo o mililitro, véase el cuadro 2, ejemplo 2.
iii) Con el fin de uniformar los criterios para
el reporte de las cuentas en ensayos donde las placas presenten situaciones no
contempladas en los ejemplos anteriores, se presentan las siguientes guías:
iv) Placas con menos de 25 colonias.- Cuando las
placas corridas para la menor dilución muestran cuentas de menos de 25
colonias, contar el número de colonias presentes en dicha dilución, promediar
el número de colonias y multiplicar por el factor de dilución para obtener el
valor estimado de cuenta en placa. Aclarar en su informe esta situación
agregando la leyenda "valor estimado", véase el cuadro 2, ejemplo 3.
v) Placas con más de 250 colonias.- Cuando el
número de colonias por placa exceda de 250, contar las colonias en aquellas
porciones de la placa que sean representativas de la distribución de colonias.
Contar por ejemplo, una cuarta parte o una mitad del área de la caja y
multiplicar el valor obtenido por 4 o 2, respectivamente. Si solamente pueden
contarse algunos cuadros, considerar que el fondo de una caja Petri de
vi) Colonias extendidas.- Las colonias
extendidas pueden presentarse en las siguientes formas:
vii) Cadenas de colonias no separadas claramente
entre sí, que parecen ser causadas por la desintegración de un cúmulo de
bacterias.
viii)
Colonias que se desarrollan
en película entre el agar y el fondo de la caja.
ix) Colonias que se desarrollan en película en
la orilla de la caja sobre la superficie del agar.
x) Colonias de crecimiento extendido y en
algunas ocasiones acompañadas de inhibición del crecimiento, que en conjunto
exceden el 50% de la caja o represión del crecimiento que por sí mismo excede
el 25% de la superficie de la caja.
xi)
Cuando es necesario contar
en cajas que contienen colonias extendidas que no están incluidas en punto x)
del numeral B.4.2.7.1, contar
cualquiera de los tipos vii), viii) o ix) del numeral B.4.2.7.1, como provenientes de una sola fuente. En el caso de las
colonias del tipo vii) del numeral B.4.2.7.1, si la caja contiene una sola
cadena, contar como una sola colonia, si la caja contiene varias cadenas que
parecen originarse de fuentes separadas, contar cada cadena como colonia
individual. No contar cada colonia de la cadena individualmente. Las colonias
del tipo vii) y ix) del numeral B.4.2.7.1,
generalmente se observan como crecimiento diferenciable de otras colonias y se
cuentan como tales. Los crecimientos tipo x) del numeral B.4.2.7.1, reportarlos como crecimiento extendido. En caso de que
una dilución se encuentre dentro del rango y otra dilución presente colonias de
crecimiento extendido, reportar la dilución en la que se pueden contar las
colonias, véase el cuadro 2, ejemplo 5
xii) Placas sin colonias.- Cuando las placas de
todas las diluciones no muestran colonias, reportar la cuenta en placa como
menor que una vez el valor de la dilución más baja usada, véase el cuadro 2,
ejemplo 6.
xiii) Placas corridas por duplicado, una con
crecimiento dentro del intervalo adecuado y otra con más de 250 colonias.-
Cuando una placa tiene entre 25 y 250 colonias y su duplicado más de 250
colonias, contar ambas placas incluyendo la que está fuera del intervalo para
determinar la cuenta en placa, véase el cuadro 2, ejemplo 7.
xiv) Placas corridas por duplicado, una placa de
cada dilución dentro del intervalo de
xv) Placas corridas por duplicado, ambas placas
de una dilución dentro del intervalo de
xvi) Después de contabilizar las colonias en las
placas seleccionadas, multiplicar por la inversa de la dilución para obtener el
número de UFC por mililitro o gramo de la muestra. Redondear la cifra obtenida
en la cuenta de manera que sólo aparezcan dos dígitos significativos al inicio
de esta cifra. Para redondear, elevar el segundo dígito al número inmediato
superior cuando el tercer dígito de la derecha sea cinco o mayor (por ejemplo:
128 redondear a 130). Si el tercer dígito es cuatro o menos, reemplazar el
tercer dígito con cero y el segundo dígito mantenerlo igual (Por ejemplo:
B.16.10
Informe de
Reportar como: Unidades formadoras de
colonias, ___ UFC/g o mL, de bacterias aerobias en placa en agar triptona
extracto de levadura o agar para cuenta estándar, incubadas ________ horas a
_______ ºC.
CUADRO 2
Cálculo de los valores de la cuenta en placa (ensayos por duplicado)
|
Ejemplo |
|
Colonias contadas |
|
UFC/ g o mL |
|
número |
1:100 |
1:1,000 |
1:10,000 |
|
|
1 |
>250 |
178 |
16 |
180,000 |
|
|
>250 |
190 |
17 |
|
|
2 |
>250 |
220 |
25 |
250,000 |
|
3 |
18 |
2 |
0 |
1,600 |
|
|
14 |
0 |
0 |
|
|
4 |
>250 |
>250 |
512 |
5,000,000 |
|
|
>250 |
>250 |
495 |
|
|
5 |
>250 |
235 |
Crecimiento extendido |
|
|
6 |
0 |
0 |
0 |
<100 |
|
7 |
>250 |
240 |
24 |
250,000 |
|
|
>250 |
268 |
19 |
|
|
8 |
>250 |
216 |
23 |
280,000 |
|
|
>250 |
262 |
42 |
|
|
9 |
>250 |
215 |
20 |
23,000 |
|
|
>250 |
235 |
26 |
|
|
|
>250 |
275 |
32 |
270,000 |
|
|
>250 |
225 |
26 |
|
B.17
Método para
B.17.1
Fundamento
El método se basa en inocular una cantidad
conocida de muestra de prueba en un medio selectivo específico, acidificado a
un pH 3,5 e incubado a una temperatura de 25 ±
B.17.2
Reactivos y materiales
B.17.2.1
Reactivos
Los reactivos que a continuación se mencionan
deben ser de grado analítico y cuando se indique agua debe entenderse como agua
destilada.
i)
Medios de cultivo.
Agar
papa - dextrosa, comercialmente disponible en forma deshidratada.
Preparación del medio de cultivo.
Seguir instrucciones del fabricante y después
de esterilizar, enfriar en baño de agua a 45 ±
B.17.2.1.1
Soluciones.
i)
Solución reguladora de fosfatos (solución concentrada)
|
Fórmula |
|
|
Ingredientes |
Cantidades |
|
Fosfato
de potasio monobásico |
|
|
Agua
|
|
Preparación:
Disolver el fosfato en 500 mL de agua y
ajustar el pH a 7,2 con hidróxido de sodio 1 N.
Llevar a
Esterilizar a
Tomar 1,25 mL de la solución concentrada y
llevar a
Distribuir en porciones de 99, 90 y 9 mL
según se requiera.
Esterilizar a 121 ±
ii)
Solución estéril de ácido tartárico al 10%
|
Fórmula |
|
|
Ingredientes |
Cantidades |
|
Acido
tartárico |
|
|
Agua
destilada |
100,
mL |
Preparación:
Disolver el ácido en el agua y esterilizar a
121 ±
B.17.2.2
Materiales.
B.17.2.2.1 Pipetas bacteriológicas para
distribuir 10 y 1 mL(o si es necesario de 1 mL y 2 mL), con tapón de algodón.
Pueden utilizarse pipetas graduadas en volúmenes iguales a una décima de su
volumen total.
B.17.2.2.2 Cajas Petri.
B.17.2.2.3 Frascos de vidrio de 250 mL con
tapón de rosca.
B.17.2.2.4 Tubos de 16 x
B.17.2.2.5 Utensilios esterilizables para la
obtención de muestras: cuchillos, pinzas, tijeras, cucharas, espátulas, etc.
B.17.2.2.6 Todo el material e instrumentos
que tengan contacto con las muestras bajo estudio, deben esterilizarse
mediante:
Horno,
durante 2 h de
B.17.2.3 Aparatos e Instrumentos
B.17.2.3.1 Horno para esterilizar que alcance una
temperatura mínima de
B.17.2.3.2 Incubadora con termostato que pueda
ser mantenido a 25 ±
B.17.2.3.3 Autoclave que alcance una
temperatura mínima de 121 ± 1,0°C.
B.17.2.3.4 Baño de agua con control de
temperatura y circulación mecánica, provista con termómetro calibrado con
divisiones de
B.17.2.3.5 Contador de colonias de campo
oscuro, con luz adecuada, placa de cristal cuadriculada y lente amplificador.
B.17.2.3.6 Registrador mecánico o
electrónico.
B.17.2.3.7 Microscopio óptico.
B.17.2.3.8 Potenciómetro con una escala
mínima de 0,1 unidades de pH a
B.17.3
Preparación de
La preparación de la muestra debe ser de
acuerdo a lo señalado en el numeral B.4.1 (Procedimiento para la preparación y
dilución de muestras de alimentos para su análisis microbiológico) de este
apéndice normativo
B.17.3.1
Procedimiento
B.17.3.1.1
Colocar por duplicado en
cajas Petri 1 mL de la muestra líquida directa o de la dilución primaria,
utilizando para tal propósito una pipeta estéril.
B.17.3.1.2
Repetir el procedimiento
tantas veces como diluciones decimales se requiera sembrar, utilizando una
pipeta estéril diferente para cada dilución.
B.17.3.1.3
Verter de
B.17.3.1.4
Mezclar cuidadosamente el
medio con seis movimientos de derecha a izquierda, seis en el sentido de las
manecillas del reloj, seis en el sentido contrario y seis de atrás para
adelante, sobre una superficie lisa. Permitir que la mezcla se solidifique dejando
las cajas Petri reposar sobre una superficie horizontal fría.
B.17.31.5
Preparar una caja control
con 15 mL de medio, para verificar la esterilidad.
B.17.3.1.6
Invertir las cajas y
colocarlas en la incubadora a 25 ±
B.17.3.1.7
Contar las colonias de cada
placa después de 3, 4 y 5 días de incubación. Después de 5 días, seleccionar
aquellas placas que contengan entre 10 y 150 colonias. Si alguna parte de la
caja muestra crecimiento extendido de mohos o si es difícil contar colonias
bien aisladas, considerar los conteos de 4 días de incubación y aun de 3 días.
En este caso, informar el periodo de incubación de 3 o 4 días en los resultados
del análisis.
B.17.3.1.8
Si es necesario, cuando la
morfología colonial no sea suficiente, examinar microscópicamente para
distinguir las colonias de levaduras y mohos de las bacterias.
B.17.4
Expresión de Resultados
Cálculo del Método
Considerar las cuentas de placas con
Multiplicar por el inverso de la dilución, tomando
en consideración los criterios del numeral B.4.2 de este apéndice (Método para
la cuenta de bacterias aerobias en placa), para la expresión de resultados.
B.17.5
Informe de
Informar:
Unidades formadoras de colonias por gramo o
mililitro (UFC/g o mL) de mohos en agar papa – dextrosa acidificado, incubadas
a 25 ±
Unidades formadoras de colonias por gramo o
mililitro (UFC/g o mL) de levaduras en agar papadextrosa acidificado, incubadas
a 25 ±
B.18. Estimación
de
Este método
es aplicable a cualquier grupo bacteriano de interés sanitario, especialmente
en productos que se encuentran en bajas concentraciones de microorganismos (10
por gramo o mL). Ejemplo: Leche, agua, alimentos; que por su consistencia
pueden interferir con la exactitud de la cuenta de Unidades Formadoras de
Colonias (U.F.C.).
B.18.1 Fundamento.
Se
basa en la dilución de la muestra en tubos múltiples, de tal forma que todos
los tubos de la menor dilución sean positivos y todos los tubos de la dilución
más alta sean negativos. El resultado positivo se demuestra por la presencia de
gas o crecimiento microbiano.
Para
obtener el Número Más Probable (NMP) en los resultados se aplica la teoría de
la probabilidad, lo cual tiene como condición lo siguiente:
- Una
distribución aleatoria de las bacterias que existen en la muestra.
- Las
bacterias se encuentran como entidades no agrupadas.
- Los
microorganismos presentes en la muestra crecerán en el medio, cuando son
incubados y se mantengan en las condiciones adecuadas para su desarrollo.
Si se
espera una cuenta microbiana alta, la muestra deberá diluirse para dar
cumplimiento a las condiciones. La forma más común de realizar esta prueba es
mediante diluciones decimales y usando un inóculo en series de 3, 5 o 10 tubos en
serie. A medida que el número de tubos inoculados para cada dilución aumentan
se reducen los límites de confianza.
B.18.2 Equipo, Materiales y Reactivos.
No
aplica.
B.18.3 Procedimientos.
B.18.3.1 Uso de tablas de NMP con 95% de
límite de confianza.
Las
tablas 1-3 presentan la estimación estadística de los valores del NMP que
corresponden al 95% de límite de confianza cuando se utilizan 3, 5 y 10 tubos.
Otras combinaciones de resultados positivos y negativos no encontrados en estas
tablas, tienen muy baja probabilidad de que se presenten. Si los resultados no
están incluidos en las tablas, se deberá
repetir la prueba a partir de la muestra original. Si no es posible, el NMP
se puede obtener (para las combinaciones de 3 y 5 tubos) de las tablas 4 y 5;
también se puede aplicar una ecuación (véase punto B.2) para obtener el NMP
aproximado.
El
intervalo del 95% de confianza se interpreta como sigue: si el analista supone
que el número real de microorganismos cae dentro de los límites, entonces se
asume que será correcto el 95% de las veces. El valor del NMP tabulado
representa un intervalo y no un valor absoluto.
Cuando
se preparan más de 3 diluciones de una muestra, el NMP deberá determinarse a
partir de tres diluciones consecutivas (usando tablas 1-3). Primero, para todas
las diluciones que tengan todos los tubos positivos, seleccionar la dilución
mayor. Después usar las 2 siguientes diluciones mayores (A y B en las tablas 6
y 7). Cuando en ninguna de las diluciones probadas hubiera crecimiento en todos
los tubos, seleccionar (si es posible) las primeras tres diluciones
consecutivas (volumen de muestra) para que la dilución media contenga
resultados positivos (C de tablas 6 y 7).
Con
frecuencia es necesario el NMP desde el inicio con volúmenes diferentes de los
enlistados en las tablas 1-5. Si el volumen de muestra es mayor que
Un
método alternativo para obtener el número más probable es usando la siguiente
fórmula:
(NMP/g
de la tabla - 100) X factor de dilución del tubo de enmedio = NMP/g
Para
calcular el NMP/100 g multiplicar por 100.
B.18.3.2 Cálculo Aproximado del NMP y 95% de límite
de confianza.
Debido
a la inherente complejidad para calcular los límites de confianza del NMP lo
más común es el uso de tablas. Generalmente estas tablas están limitadas al uso
de 3, 5 y 10 tubos por dilución, incluso usando un método aceptado, pueden
presentarse datos irregulares o accidentes de laboratorio que causan pérdida de
1 o más tubos de dilución. En este caso una serie de diluciones de por ejemplo:
5,4,4 puede dar una lectura de 5-2-0. Para estos casos se puede aplicar una
fórmula sencilla, la cual no corresponde exactamente con los resultados
obtenidos teóricamente; sin embargo, las desviaciones generalmente son
pequeñas, esta fórmula no debe ser aplicada para fines de regulación. La
fórmula no restringe el número de tubos o las diluciones y puede aplicarse para
todo tipo de pruebas. El cálculo aproximado está dado por la siguiente
ecuación: NMP/g = P/(N T)1/2
Donde:
P es el número de tubos positivos, N es la cantidad total de muestra (g) en
todos los tubos negativos y T es la cantidad total de muestra (g) en
todos los tubos.
Por
ejemplo, considerando que se tuvieran serie de diluciones al doble:
|
MUESTRA
(g) |
No.
DE TUBOS |
No.
DE TUBOS POSITIVOS |
|
8 4 2 1 0,5 0,25 |
5 5 5 5 5 5 |
5 4 2 0 1 0 |
El
número de tubos positivos es: P = (5 + 4 + 2+ 1) = 12; N = (8x0) + (4x1)
+ (2x3) + (1x5) + (0,5x4) + (0,25x5) = 18,25; y T = 5 (8+4+2+1+0,5+0,25)
= 78,75
NPM/g = 12/(18,25 x 78,75)1/2 = 0,32/g o 32/100 g
Los
límites de confianza del 95% estimado, pueden obtenerse del antilogaritmo de
base 10 con la siguiente ecuación:
log (NMP/g) 1,08 (log a)/n) 1/2
Donde:
a es el radio de dilución y n es el número de tubos por dilución. Esta
expresión asume que el radio de dilución es diferente de 1:10 (por ejemplo 1:2).
Para diluciones de 1:10, la cantidad por restar o sumar deberá ser de 1,14(n)½ para
la mejor estimación. Si el número de tubos por dilución (ni) es
desigual (por ejemplo: un accidente de laboratorio) para la dilución k
reemplazar n por la expresión nH (media armónica)
por el número de tubos por dilución (ni).
La
media armónica se define como:
nH
= k / (1/ ni )
k es
el número de diluciones. Por ejemplo: Suponiendo que el resultado de 3
diluciones en ni fuera 5-4-4.
Por lo
tanto nH = 3/ (1/5) + (1/4) + (1/4) ½ = 3/0,70 = 4,3i
Para
el ejemplo anterior el NMP con n = 5 y un límite de confianza aproximado de 95%
será el siguiente:
log 0,32 (1,08) (log 2)/5) ½
-0,495 0,265
Entonces
el límite inferior es el antilogaritmo (-0-76) = 0.17/g o 17/100 g y el límite
inferior es el antilogaritmo (-0,23) = 0,59/g o 59/100 g. Cuando se compara con
las tablas el NMP podría ser 0,31/g con límites de confianza de 0,16/g y
0,57/g.
Tabla No. 1 Selección del NMP con un límite
de confianza de 95% para la prueba de fermentación utilizando 3 tubos: con
porciones de 0,1, 0,01 y
|
No.
de tubos positivos |
|
95%
de límite de confianza |
|||
|
0,1 |
0,01 |
0,001 |
NMP/g
(mL)b |
Inferior |
Superior |
|
0 |
0 |
0 |
3 |
- |
- |
|
0 |
1 |
0 |
3+ |
1 |
17 |
|
1 |
0 |
0 |
4 |
1 |
21 |
|
1 |
0 |
1 |
7+ |
2 |
27 |
|
1 |
1 |
0 |
7 |
2 |
28 |
|
1 |
2 |
0 |
11+ |
4 |
35 |
|
2 |
0 |
0 |
9 |
2 |
38 |
|
2 |
0 |
1 |
14+ |
5 |
48 |
|
2 |
1 |
0 |
15 |
5 |
50 |
|
2 |
1 |
1 |
20+ |
7 |
60 |
|
2 |
2 |
0 |
21 |
8 |
62 |
|
3 |
0 |
0 |
23 |
9 |
130 |
|
3 |
0 |
1 |
39 |
10 |
180 |
|
3 |
1 |
0 |
43 |
10 |
210 |
|
3 |
1 |
1 |
75 |
20 |
280 |
|
3 |
2 |
0 |
93 |
30 |
380 |
|
3 |
2 |
1 |
150 |
50 |
500 |
|
3 |
2 |
2 |
210+ |
80 |
640 |
|
3 |
3 |
0 |
240 |
90 |
1400 |
|
3 |
3 |
1 |
460 |
100 |
2400 |
|
3 |
3 |
2 |
1100 |
300 |
4800 |
|
3 |
3 |
3 |
1100 |
- |
- |
a Los
resultados normales, obtenidos en un 95% de las pruebas no están seguidos por
un símbolo más (+). Menos del 4% de los resultados de las pruebas obtenidos
están marcados por un símbolo más (+). Combinaciones de tubos positivos no
encontrados en esta tabla se presentan en menos del 1% de las pruebas y si se
presentaran con mayor frecuencia indican un error de técnica o que el valor del
número más probable se encuentra en el límite. El NMP de combinaciones que no
aparecen en la tabla, se puede obtener por extrapolación a la combinación
cercana más elevada.
b Multiplicar
todos los valores de NMP/g (mL) por 100 para expresarlos como NMP/100 g (mL).
Tabla No. 2 Selección del NMP con un límite
de confianza de 95% para la prueba de fermentación utilizando 5 tubos: con
porciones de 0,1, 0,01 y
|
No.
de tubos positivos |
|
95%
de límite de confianza |
|||
|
0,1 |
0,01 |
0,001 |
NMP/g
(mL)b |
Inferior |
Superior |
|
|
|
|
|
|
|
|
0 |
0 |
0 |
2 |
- |
- |
|
0 |
0 |
1 |
2+ |
1 |
10 |
|
0 |
1 |
0 |
2 |
1 |
10 |
|
1 |
0 |
0 |
2 |
1 |
11 |
|
1 |
0 |
1 |
4+ |
1 |
15 |
|
1 |
1 |
0 |
4 |
1 |
15 |
|
1 |
2 |
0 |
6+ |
2 |
18 |
|
2 |
0 |
0 |
4 |
1 |
17 |
|
2 |
0 |
1 |
7+ |
2 |
20 |
|
2 |
1 |
0 |
7 |
2 |
21 |
|
2 |
1 |
1 |
9+ |
3 |
25 |
|
2 |
2 |
0 |
9 |
3 |
25 |
|
3 |
0 |
0 |
8 |
3 |
24 |
|
3 |
0 |
1 |
11 |
4 |
29 |
|
3 |
1 |
0 |
11 |
4 |
30 |
|
3 |
1 |
1 |
14+ |
6 |
35 |
|
3 |
2 |
0 |
14 |
6 |
35 |
|
3 |
2 |
1 |
17+ |
7 |
40 |
|
3 |
3 |
0 |
17+ |
7 |
41 |
|
4 |
0 |
0 |
13 |
5 |
38 |
|
4 |
0 |
1 |
17 |
7 |
45 |
|
4 |
1 |
0 |
17 |
7 |
46 |
|
4 |
1 |
1 |
21 |
9 |
55 |
|
4 |
2 |
0 |
22 |
9 |
56 |
|
4 |
2 |
1 |
26+ |
12 |
65 |
|
4 |
3 |
0 |
27 |
12 |
67 |
|
4 |
3 |
1 |
33+ |
15 |
77 |
|
4 |
4 |
0 |
34+ |
16 |
80 |
|
5 |
0 |
0 |
23 |
9 |
68 |
|
5 |
0 |
1 |
31 |
13 |
110 |
|
5 |
1 |
0 |
33 |
14 |
120 |
|
5 |
1 |
1 |
46 |
20 |
150 |
|
5 |
1 |
2 |
63+ |
22 |
180 |
|
5 |
2 |
0 |
49 |
21 |
170 |
|
5 |
2 |
1 |
70 |
30 |
210 |
|
5 |
2 |
2 |
94+ |
40 |
250 |
|
5 |
3 |
0 |
79 |
30 |
250 |
|
5 |
3 |
1 |
110 |
40 |
300 |
|
5 |
3 |
2 |
140 |
60 |
360 |
|
5 |
4 |
0 |
130 |
50 |
390 |
|
5 |
4 |
1 |
170 |
70 |
480 |
|
5 |
4 |
2 |
220 |
100 |
580 |
|
5 |
4 |
3 |
280+ |
120 |
690 |
|
5 |
4 |
4 |
350+ |
160 |
820 |
|
5 |
5 |
0 |
240 |
100 |
940 |
|
5 |
5 |
1 |
350 |
100 |
1300 |
|
5 |
5 |
2 |
540 |
220 |
2000 |
|
5 |
5 |
3 |
920 |
300 |
2900 |
|
5 |
5 |
4 |
1600 |
600 |
5300 |
|
5 |
5 |
5 |
1600 |
- |
- |
a Los resultados
normales, obtenidos en un 95% de las pruebas, no están seguidos por un símbolo
más(+). Menos del 4% de los resultados de las pruebas obtenidos están marcados
por un símbolo más (+). Combinaciones de tubos positivos no encontrados en esta
tabla se presentan en menos del 1% de las pruebas y si se presentaran con mayor
frecuencia indican un error de técnica o que el valor del número más probable
se encuentra en el límite. El NMP de combinaciones que no aparecen en la tabla,
se pueden obtener por extrapolación a la combinación cercana más elevada.
b Multiplicar
todos los valores de NMP/g (mL) por 100 para expresarlos como NMP/100 g (mL).
Tabla No. 3 Selección del NMP con un límite
de confianza de 95% para la prueba de fermentación utilizando 10 tubos: con
porciones de 0,1, 0,01 y
|
No. de tubos positivos |
|
95% de límite de
confianza |
|||
|
0,1 |
0,01 |
0,001 |
NMP/g (mL)b |
Inferior |
Superior |
|
0 |
0 |
0 |
1 |
- |
- |
|
0 |
0 |
1 |
1+ |
1 |
5 |
|
0 |
1 |
0 |
1 |
1 |
5 |
|
0 |
2 |
0 |
2+ |
1 |
7 |
|
1 |
0 |
0 |
1 |
1 |
5 |
|
1 |
0 |
1 |
2+ |
1 |
7 |
|
1 |
1 |
0 |
2 |
1 |
7 |
|
1 |
2 |
0 |
3+ |
1 |
8 |
|
2 |
0 |
0 |
2 |
1 |
7 |
|
2 |
0 |
1 |
3+ |
1 |
9 |
|
2 |
1 |
0 |
3 |
1 |
9 |
|
2 |
1 |
1 |
4+ |
1 |
10 |
|
2 |
2 |
0 |
4 |
2 |
10 |
|
2 |
3 |
0 |
5+ |
2 |
12 |
|
3 |
0 |
0 |
3 |
1 |
9 |
|
3 |
0 |
1 |
4 |
2 |
11 |
|
3 |
1 |
0 |
4 |
2 |
11 |
|
3 |
1 |
1 |
5+ |
2 |
13 |
|
3 |
2 |
0 |
5 |
2 |
13 |
|
3 |
2 |
1 |
6+ |
3 |
14 |
|
3 |
3 |
0 |
6+ |
3 |
14 |
|
4 |
0 |
0 |
4 |
2 |
12 |
|
4 |
0 |
1 |
6 |
2 |
13 |
|
4 |
1 |
0 |
6 |
2 |
14 |
|
4 |
1 |
1 |
7 |
3 |
15 |
|
4 |
2 |
0 |
7 |
3 |
15 |
|
4 |
2 |
1 |
8 |
4 |
17 |
|
4 |
3 |
0 |
8 |
4 |
17 |
|
4 |
4 |
0 |
9+ |
5 |
19 |
|
5 |
0 |
0 |
6 |
2 |
15 |
|
5 |
0 |
1 |
7 |
3 |
16 |
|
5 |
1 |
0 |
7 |
3 |
17 |
|
5 |
1 |
1 |
9 |
4 |
18 |
|
5 |
2 |
0 |
9 |
4 |
18 |
|
5 |
2 |
1 |
10+ |
5 |
20 |
|
5 |
3 |
0 |
10 |
5 |
20 |
|
5 |
3 |
1 |
11+ |
6 |
22 |
|
5 |
4 |
0 |
11+ |
6 |
22 |
|
6 |
0 |
0 |
8 |
3 |
18 |
|
6 |
0 |
1 |
9 |
4 |
20 |
|
6 |
1 |
0 |
9 |
4 |
20 |
|
6 |
1 |
1 |
11 |
5 |
22 |
|
6 |
2 |
0 |
11 |
5 |
22 |
|
6 |
2 |
1 |
12 |
6 |
24 |
|
6 |
3 |
0 |
12 |
6 |
25 |
|
6 |
3 |
1 |
14+ |
7 |
27 |
|
6 |
4 |
0 |
14+ |
7 |
27 |
|
6 |
5 |
0 |
15+ |
8 |
29 |
|
7 |
0 |
0 |
10 |
5 |
22 |
|
7 |
0 |
1 |
12 |
6 |
24 |
|
7 |
0 |
2 |
13+ |
7 |
27 |
|
7 |
1 |
0 |
12 |
6 |
25 |
|
7 |
1 |
1 |
13 |
7 |
27 |
|
7 |
1 |
2 |
15+ |
8 |
30 |
|
7 |
2 |
0 |
13 |
7 |
27 |
|
7 |
2 |
1 |
15 |
8 |
30 |
|
7 |
2 |
2 |
17+ |
9 |
32 |
|
7 |
3 |
0 |
15 |
8 |
30 |
|
7 |
3 |
1 |
17 |
9 |
33 |
|
7 |
4 |
0 |
17 |
9 |
33 |
|
7 |
4 |
1 |
19+ |
10 |
36 |
|
7 |
5 |
0 |
19+ |
10 |
36 |
|
8 |
0 |
0 |
13 |
6 |
28 |
|
8 |
0 |
1 |
15 |
7 |
31 |
|
8 |
0 |
2 |
17+ |
8 |
34 |
|
8 |
1 |
0 |
15 |
7 |
31 |
|
8 |
1 |
1 |
17 |
9 |
34 |
|
8 |
1 |
2 |
19+ |
10 |
37 |
|
8 |
2 |
0 |
17 |
9 |
35 |
|
8 |
2 |
1 |
19 |
10 |
38 |
|
8 |
2 |
2 |
21+ |
12 |
42 |
|
8 |
3 |
0 |
19 |
10 |
39 |
|
8 |
3 |
1 |
21 |
12 |
42 |
|
8 |
3 |
2 |
24+ |
13 |
46 |
|
8 |
4 |
0 |
22 |
12 |
43 |
|
8 |
4 |
1 |
24 |
13 |
46 |
|
8 |
5 |
0 |
24 |
13 |
47 |
|
8 |
5 |
1 |
27+ |
15 |
51 |
|
8 |
6 |
0 |
27+ |
15 |
52 |
|
9 |
0 |
0 |
17 |
8 |
37 |
|
9 |
0 |
1 |
19 |
10 |
41 |
|
9 |
0 |
2 |
22+ |
11 |
46 |
|
9 |
1 |
0 |
19 |
10 |
42 |
|
9 |
1 |
1 |
22 |
11 |
47 |
|
9 |
1 |
2 |
25+ |
13 |
52 |
|
9 |
2 |
0 |
22 |
12 |
47 |
|
9 |
2 |
1 |
25 |
13 |
53 |
|
9 |
2 |
2 |
28+ |
15 |
58 |
|
9 |
3 |
0 |
25 |
13 |
54 |
|
9 |
3 |
1 |
29 |
15 |
60 |
|
9 |
3 |
2 |
32+ |
18 |
66 |
|
9 |
4 |
0 |
29 |
16 |
61 |
|
9 |
4 |
1 |
33 |
18 |
67 |
|
9 |
4 |
2 |
37+ |
20 |
74 |
|
9 |
5 |
0 |
33 |
18 |
69 |
|
9 |
5 |
1 |
37 |
20 |
76 |
|
9 |
5 |
2 |
42+ |
23 |
83 |
|
9 |
6 |
0 |
38 |
21 |
77 |
|
9 |
6 |
1 |
43+ |
24 |
85 |
|
9 |
7 |
0 |
44+ |
24 |
87 |
|
10 |
0 |
0 |
23 |
12 |
58 |
|
10 |
0 |
1 |
27 |
14 |
67 |
|
10 |
0 |
2 |
31+ |
16 |
77 |
|
10 |
1 |
0 |
27 |
14 |
69 |
|
10 |
1 |
1 |
32 |
17 |
79 |
|
10 |
1 |
2 |
38 |
20 |
92 |
|
10 |
2 |
0 |
33 |
17 |
83 |
|
10 |
2 |
1 |
39 |
20 |
96 |
|
10 |
2 |
2 |
50 |
20 |
110 |
|
10 |
2 |
3 |
50+ |
30 |
120 |
|
10 |
3 |
0 |
40 |
20 |
100 |
|
10 |
3 |
1 |
50 |
20 |
120 |
|
10 |
3 |
2 |
60+ |
30 |
130 |
|
10 |
3 |
3 |
70+ |
30 |
150 |
|
10 |
4 |
0 |
50 |
30 |
120 |
|
10 |
4 |
1 |
60 |
30 |
140 |
|
10 |
4 |
2 |
70 |
30 |
160 |
|
10 |
4 |
3 |
80+ |
40 |
170 |
|
10 |
5 |
0 |
60 |
30 |
150 |
|
10 |
5 |
1 |
70 |
40 |
170 |
|
10 |
5 |
2 |
90 |
40 |
190 |
|
10 |
5 |
3 |
100 |
50 |
210 |
|
10 |
6 |
0 |
80 |
40 |
180 |
|
10 |
6 |
1 |
90 |
50 |
200 |
|
10 |
6 |
2 |
110 |
50 |
230 |
|
10 |
6 |
3 |
120 |
60 |
250 |
|
10 |
6 |
4 |
140+ |
70 |
270 |
|
10 |
7 |
0 |
100 |
50 |
220 |
|
10 |
7 |
1 |
120 |
60 |
250 |
|
10 |
7 |
2 |
140 |
70 |
280 |
|
10 |
7 |
3 |
150 |
80 |
310 |
|
10 |
7 |
4 |
170+ |
90 |
340 |
|
10 |
8 |
0 |
130 |
60 |
280 |
|
10 |
8 |
1 |
150 |
80 |
320 |
|
10 |
8 |
2 |
170 |
90 |
360 |
|
10 |
8 |
3 |
200 |
100 |
400 |
|
10 |
8 |
4 |
220 |
120 |
440 |
|
10 |
8 |
5 |
250+ |
140 |
480 |
|
10 |
9 |
0 |
170 |
90 |
380 |
|
10 |
9 |
1 |
200 |
100 |
430 |
|
10 |
9 |
2 |
230 |
120 |
490 |
|
10 |
9 |
3 |
260 |
140 |
560 |
|
10 |
9 |
4 |
300 |
160 |
640 |
|
10 |
9 |
5 |
350 |
180 |
720 |
|
10 |
9 |
6 |
400+ |
210 |
820 |
|
10 |
10 |
0 |
240 |
120 |
610 |
|
10 |
10 |
1 |
290 |
150 |
750 |
|
10 |
10 |
2 |
350 |
170 |
910 |
|
10 |
10 |
3 |
400 |
200 |
1100 |
|
10 |
10 |
4 |
500 |
300 |
1400 |
|
10 |
10 |
5 |
700 |
300 |
1700 |
|
10 |
10 |
6 |
900 |
400 |
2100 |
|
10 |
10 |
7 |
1120 |
600 |
2700 |
|
10 |
10 |
8 |
1160 |
800 |
3700 |
|
10 |
10 |
9 |
2300 |
1100 |
6000 |
|
10 |
10 |
10 |
2300 |
- |
- |
a Los
resultados normales, obtenidos en un 95% de las pruebas, no están seguidos por
un símbolo más (+). Menos del 4% de los resultados de las pruebas obtenidos
están marcados por un símbolo más(+). Combinaciones de tubos positivos no
encontrados en esta tabla se presentan en menos del 1% de las pruebas y si se
presentaran con mayor frecuencia indican un error de técnica o que el valor del número más probable se encuentra en el
límite. El NMP de combinaciones que no aparecen en la tabla, se pueden obtener
por extrapolación a la combinación cercana más elevada.
b Multiplicar
todos los valores de NMP/g (mL) por 100 para expresarlos como NMP/100 g (mL).
Tabla No. 4 Número más probable (NMP) para 1g
de muestra cuando se usan 3 tubos con porciones de 0,1, 0,01 y 0,001g.
|
Tubos Positivos |
Tubos Positivos |
Tubos Positivos |
Tubos Positivos |
||||||||||||
|
0,1 |
0,01 |
0,001 |
NMP |
0,1 |
0,01 |
0,001 |
NMP |
0,1 |
0,01 |
0,001 |
NMP |
0,1 |
0,01 |
0,001 |
NMP |
|
0 |
0 |
0 |
3 |
1 |
0 |
0 |
3,6 |
2 |
0 |
0 |
9,1 |
3 |
0 |
0 |
23 |
|
0 |
0 |
1 |
3 |
1 |
0 |
1 |
7,2 |
2 |
0 |
1 |
14 |
3 |
0 |
1 |
39 |
|
0 |
0 |
2 |
6 |
1 |
0 |
2 |
11 |
2 |
0 |
2 |
20 |
3 |
0 |
2 |
64 |
|
0 |
0 |
3 |
9 |
1 |
0 |
3 |
15 |
2 |
0 |
3 |
26 |
3 |
0 |
3 |
95 |
|
0 |
1 |
0 |
3 |
1 |
1 |
0 |
7,3 |
2 |
1 |
0 |
15 |
3 |
1 |
0 |
43 |
|
0 |
1 |
1 |
6,1 |
1 |
1 |
1 |
11 |
2 |
1 |
1 |
20 |
3 |
1 |
1 |
75 |
|
0 |
1 |
2 |
9,2 |
1 |
1 |
2 |
15 |
2 |
1 |
2 |
27 |
3 |
1 |
2 |
120 |
|
0 |
1 |
3 |
12 |
1 |
1 |
3 |
19 |
2 |
1 |
3 |
34 |
3 |
1 |
3 |
160 |
|
0 |
2 |
0 |
6,2 |
1 |
2 |
0 |
11 |
2 |
2 |
0 |
21 |
3 |
2 |
0 |
93 |
|
0 |
2 |
1 |
9,3 |
1 |
2 |
1 |
15 |
2 |
2 |
1 |
28 |
3 |
2 |
1 |
150 |
|
0 |
2 |
2 |
12 |
1 |
2 |
2 |
20 |
2 |
2 |
2 |
35 |
3 |
2 |
2 |
210 |
|
0 |
2 |
3 |
16 |
1 |
2 |
3 |
24 |
2 |
2 |
3 |
42 |
3 |
2 |
3 |
290 |
|
0 |
3 |
0 |
9,4 |
1 |
3 |
0 |
16 |
2 |
3 |
0 |
29 |
3 |
3 |
0 |
240 |
|
0 |
3 |
1 |
13 |
1 |
3 |
1 |
20 |
2 |
3 |
1 |
36 |
3 |
3 |
1 |
460 |
|
0 |
3 |
2 |
16 |
1 |
3 |
2 |
24 |
2 |
3 |
2 |
44 |
3 |
3 |
2 |
1100 |
|
0 |
3 |
3 |
19 |
1 |
3 |
3 |
29 |
2 |
3 |
3 |
53 |
3 |
3 |
3 |
1100 |
Tabla No. 5 Número más probable (NMP) para
100 mL de muestra cuando se usan 5 porciones en cada una de 3 diluciones con
series geométricas.
|
No. de Tubos Positivos |
No. de Tubos Positivos |
No. de Tubos Positivos |
No. de Tubos Positivos |
No. de Tubos Positivos |
No. de Tubos Positivos |
||||||||||||||||||
|
10 1 0,1 |
10 1 0,1 |
10 1 0,1 |
10 1 0,1 |
10 1 0,1 |
10 1 0,1 |
||||||||||||||||||
|
mL |
mL |
mL |
N M P |
mL |
mL |
mL |
N M P |
mL |
mL |
mL |
N M P |
mL |
mL |
mL |
N M P |
mL |
mL |
mL |
N M P |
mL |
mL |
mL |
N M P |
|
0 |
0 |
0 |
|
1 |
0 |
0 |
2 |
2 |
0 |
0 |
4,5 |
3 |
0 |
0 |
7,8 |
4 |
0 |
0 |
13 |
5 |
0 |
0 |
23 |
|
0 |
0 |
1 |
1,8 |
1 |
0 |
1 |
4 |
2 |
0 |
1 |
6,8 |
3 |
0 |
1 |
11 |
4 |
0 |
1 |
17 |
5 |
0 |
1 |
31 |
|
0 |
0 |
2 |
3,6 |
1 |
0 |
2 |
6 |
2 |
0 |
2 |
9,1 |
3 |
0 |
2 |
13 |
4 |
0 |
2 |
21 |
5 |
0 |
2 |
43 |
|
0 |
0 |
3 |
5,4 |
1 |
0 |
3 |
8 |
2 |
0 |
3 |
12 |
3 |
0 |
3 |
16 |
4 |
0 |
3 |
25 |
5 |
0 |
3 |
58 |
|
0 |
0 |
4 |
7,2 |
1 |
0 |
4 |
10 |
2 |
0 |
4 |
14 |
3 |
0 |
4 |
20 |
4 |
0 |
4 |
30 |
5 |
0 |
4 |
76 |
|
0 |
0 |
5 |
9,0 |
1 |
0 |
5 |
12 |
2 |
0 |
5 |
16 |
3 |
0 |
5 |
23 |
4 |
0 |
5 |
36 |
5 |
0 |
5 |
95 |
|
0 |
1 |
0 |
1,8 |
1 |
1 |
0 |
4 |
2 |
1 |
0 |
6,8 |
3 |
1 |
0 |
11 |
4 |
1 |
0 |
17 |
5 |
1 |
0 |
33 |
|
0 |
1 |
1 |
3,6 |
1 |
1 |
1 |
6,1 |
2 |
1 |
1 |
9,2 |
3 |
1 |
1 |
14 |
4 |
1 |
1 |
21 |
5 |
1 |
1 |
46 |
|
0 |
1 |
2 |
5,5 |
1 |
1 |
2 |
8,1 |
2 |
1 |
2 |
12 |
3 |
1 |
2 |
17 |
4 |
1 |
2 |
26 |
5 |
1 |
2 |
64 |
|
0 |
1 |
3 |
7,3 |
1 |
1 |
3 |
10 |
2 |
1 |
3 |
14 |
3 |
1 |
3 |
20 |
4 |
1 |
3 |
31 |
5 |
1 |
3 |
84 |
|
0 |
1 |
4 |
9,1 |
1 |
1 |
4 |
12 |
2 |
1 |
4 |
17 |
3 |
1 |
4 |
23 |
4 |
1 |
4 |
35 |
5 |
1 |
4 |
110 |
|
0 |
1 |
5 |
11 |
1 |
1 |
5 |
14 |
2 |
1 |
5 |
19 |
3 |
1 |
5 |
27 |
4 |
1 |
5 |
42 |
5 |
1 |
5 |
130 |
|
0 |
2 |
0 |
3,7 |
1 |
2 |
0 |
6,1 |
2 |
2 |
0 |
9,3 |
3 |
2 |
0 |
14 |
4 |
2 |
0 |
22 |
5 |
2 |
0 |
49 |
|
0 |
2 |
1 |
5,5 |
1 |
2 |
1 |
8,2 |
2 |
2 |
1 |
12 |
3 |
2 |
1 |
17 |
4 |
2 |
1 |
26 |
5 |
2 |
1 |
70 |
|
0 |
2 |
2 |
7,4 |
1 |
2 |
2 |
10 |
2 |
2 |
2 |
14 |
3 |
2 |
2 |
20 |
4 |
2 |
2 |
32 |
5 |
2 |
2 |
95 |
|
0 |
2 |
3 |
9,2 |
1 |
2 |
3 |
12 |
2 |
2 |
3 |
17 |
3 |
2 |
3 |
24 |
4 |
2 |
3 |
38 |
5 |
2 |
3 |
120 |
|
0 |
2 |
4 |
11 |
1 |
2 |
4 |
15 |
2 |
2 |
4 |
19 |
3 |
2 |
4 |
27 |
4 |
2 |
4 |
44 |
5 |
2 |
4 |
150 |
|
0 |
2 |
5 |
13 |
1 |
2 |
5 |
17 |
2 |
2 |
5 |
22 |
3 |
2 |
5 |
31 |
4 |
2 |
5 |
50 |
5 |
2 |
5 |
180 |
|
0 |
3 |
0 |
5,6 |
1 |
3 |
0 |
8,3 |
2 |
3 |
0 |
12 |
3 |
3 |
0 |
17 |
4 |
3 |
0 |
27 |
5 |
3 |
0 |
79 |
|
0 |
3 |
1 |
7,4 |
1 |
3 |
1 |
10 |
2 |
3 |
1 |
14 |
3 |
3 |
1 |
21 |
4 |
3 |
1 |
33 |
5 |
3 |
1 |
110 |
|
0 |
3 |
2 |
9,3 |
1 |
3 |
2 |
13 |
2 |
3 |
2 |
17 |
3 |
3 |
2 |
24 |
4 |
3 |
2 |
39 |
5 |
3 |
2 |
140 |
|
0 |
3 |
3 |
11 |
1 |
3 |
3 |
15 |
2 |
3 |
3 |
20 |
3 |
3 |
3 |
28 |
4 |
3 |
3 |
45 |
5 |
3 |
3 |
180 |
|
0 |
3 |
4 |
13 |
1 |
3 |
4 |
17 |
2 |
3 |
4 |
22 |
3 |
3 |
4 |
31 |
4 |
3 |
4 |
52 |
5 |
3 |
4 |
210 |
|
0 |
3 |
5 |
15 |
1 |
3 |
5 |
19 |
2 |
3 |
5 |
25 |
3 |
3 |
5 |
35 |
4 |
3 |
5 |
59 |
5 |
3 |
5 |
250 |
|
0 |
4 |
0 |
7,5 |
1 |
4 |
0 |
11 |
2 |
4 |
0 |
15 |
3 |
4 |
0 |
21 |
4 |
4 |
0 |
34 |
5 |
4 |
0 |
130 |
|
0 |
4 |
1 |
9,4 |
1 |
4 |
1 |
13 |
2 |
4 |
1 |
17 |
3 |
4 |
1 |
24 |
4 |
4 |
1 |
40 |
5 |
4 |
1 |
170 |
|
0 |
4 |
2 |
11 |
1 |
4 |
2 |
15 |
2 |
4 |
2 |
20 |
3 |
4 |
2 |
28 |
4 |
4 |
2 |
47 |
5 |
4 |
2 |
220 |
|
0 |
4 |
3 |
13 |
1 |
4 |
3 |
17 |
2 |
4 |
3 |
23 |
3 |
4 |
3 |
32 |
4 |
4 |
3 |
54 |
5 |
4 |
3 |
280 |
|
0 |
4 |
4 |
15 |
1 |
4 |
4 |
19 |
2 |
4 |
4 |
25 |
3 |
4 |
4 |
36 |
4 |
4 |
4 |
62 |
5 |
4 |
4 |
350 |
|
0 |
4 |
5 |
17 |
1 |
4 |
5 |
22 |
2 |
4 |
5 |
28 |
3 |
4 |
5 |
40 |
4 |
4 |
5 |
69 |
5 |
4 |
5 |
430 |
|
0 |
5 |
0 |
9,4 |
1 |
5 |
0 |
13 |
2 |
5 |
0 |
17 |
3 |
5 |
0 |
25 |
4 |
5 |
0 |
41 |
5 |
5 |
0 |
240 |
|
0 |
5 |
1 |
11 |
1 |
5 |
1 |
15 |
2 |
5 |
1 |
20 |
3 |
5 |
1 |
29 |
4 |
5 |
1 |
48 |
5 |
5 |
1 |
350 |
|
0 |
5 |
2 |
13 |
1 |
5 |
2 |
17 |
2 |
5 |
2 |
23 |
3 |
5 |
2 |
32 |
4 |
5 |
2 |
56 |
5 |
5 |
2 |
540 |
|
0 |
5 |
3 |
15 |
1 |
5 |
3 |
19 |
2 |
5 |
3 |
26 |
3 |
5 |
3 |
37 |
4 |
5 |
3 |
64 |
5 |
5 |
3 |
920 |
|
0 |
5 |
4 |
17 |
1 |
5 |
4 |
22 |
2 |
5 |
4 |
29 |
3 |
5 |
4 |
41 |
4 |
5 |
4 |
72 |
5 |
5 |
4 |
1600 |
|
0 |
5 |
5 |
19 |
1 |
5 |
5 |
24 |
2 |
5 |
5 |
32 |
3 |
5 |
5 |
45 |
4 |
5 |
5 |
81 |
|
|
|
|
Tabla No. 6 Ejemplos para determinar el NMP
estimado en series de tres tubos con 1g (mL) de muestra por tubo.
|
|
Cantidad
de muestra (g o mL)a |
Valores
positivos reportados |
NMP
estimado/g o mLb |
||||||
|
Ejemplo |
0,10 |
,001 |
0,001 |
0,0001 |
0,00001 |
|
|
||
|
A |
3/3 |
3/3 |
2/3 |
0/3 |
0/3 |
3-2-0 |
930 |
|
|
|
B |
3/3 |
3/3 |
3/3 |
2/3 |
0/3 |
3-2-0 |
9300 |
|
|
|
C |
0/3 |
0/3 |
1/3 |
0/3 |
0/3 |
0-1-0 |
30 |
|
|
|
D |
3/3 |
3/3 |
2/3 |
1/3 |
1/3 |
3-2-2 |
2100 |
|
|
|
E |
3/3 |
3/3 |
3/3 |
3/3 |
3/3 |
3-3-3 |
110000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
a Numerador/denominador
= número de tubos positivos/número de tubos inoculados.
b Multiplicar
todos los valores de NMP/g (mL) por 100 para expresarlos como NMP/100 g (mL).
Tabla No. 7 Ejemplos para determinar el NMP
estimado en series de 5 tubos con
|
|
Cantidad
de muestra (g o mL)a |
Valores
positivos |
NMP
estimado/g o mLb |
||||||
|
Ejemplo |
0,1, |
0,01 |
0,001 |
0,0001 |
0,00001 |
reportados |
|
||
|
A |
5/5 |
5/5 |
2/5 |
0/5 |
0/5 |
5-2-0 |
490 |
|
|
|
B |
5/5 |
5/5 |
5/5 |
2/5 |
0/5 |
5-2-0 |
4900 |
|
|
|
C |
0/5 |
0/5 |
1/5 |
0/5 |
0/5 |
0-1-0 |
20 |
|
|
|
D |
5/5 |
5/5 |
3/5 |
1/5 |
1/5 |
5-2-2 |
1400 |
|
|
|
E |
5/5 |
5/5 |
5/5 |
5/5 |
5/5 |
5-5-5 |
160000 |
|
|
a Numerador/denominador
= número de tubos positivos/número de tubos inoculados.
b Multiplicar
todos los valores de NMP/g (mL) por 100 para expresarlos como NMP/100 g (mL).
B.18.3.3 Determinación de Bacterias Coliformes,
Coliformes fecales y Escherichia coli
por
B.18.3.3.1 Fundamento
Este
método se basa en la propiedad de los microorganismos coliformes para producir
gas a partir de glucosa y fermentación de lactosa dentro de las 48 horas de
incubación a 35
B.18.3.3.2 Equipo y Materiales
Además
de los mencionados en el método Preparación y dilución de muestras de alimentos
para análisis microbiológico, lo siguiente:
- Baño
de agua con agitación continua cubierto y con termostato que evite variaciones
mayores a 0,1°C.
-
Termómetro calibrado y verificado 1/10
-
Tubos de cultivo de 20x200 y de 16x160 mm con tapón de rosca
-
Campanas de fermentación (tubos de Durham)
-
Gradillas
- Asas
bacteriológicas de
-
Lámpara de luz ultravioleta de longitud amplia 4 watts.
-
Lentes protectores.
B.18.3.3.3 Medios de Cultivo
Caldo Lauril
Ingredientes:
|
Bacto
triptosa |
|
|
Bacto
lactosa |
|
|
Fosfato
potásico, dibásico |
|
|
Fosfato
potásico, monobásico |
|
|
Cloruro
de sodio |
|
|
Lauril
sulfato de sodio |
|
|
Agua
destilada |
1000,0
mL |
pH
final: 6,8
Preparación:
1.
Disolver los ingredientes en un litro de agua destilada.
2.
Ajustar el pH.
3.
Distribuir en tubos de ensaye con campanas de Durham.
4.
Adicionar 10 mL de medio para cada tubo.
5.
Esterilizar en autoclave durante 15 minutos a
6.
Antes de abrir el autoclave, dejar bajar la temperatura a
Preparación de Caldo Lauril Triptosa
|
INOCULO (mL) |
CANTIDAD
DE MEDIO POR TUBO (mL) |
VOLUMEN
DE MEDIO MAS INOCULO (mL) |
CALDO
LAURIL TRIPTOSA REQUERIDO g/L |
|
1 |
10
o más |
11
o más |
35,6 |
|
10 |
10 |
20 |
71,2 |
|
10 |
20 |
30 |
53,4 |
|
20 |
10 |
30 |
106,8 |
|
100 |
50 |
150 |
106,8 |
|
100 |
35 |
135 |
137,1 |
|
100 |
20 |
120 |
213,6 |
Caldo EC (E.
coli.)
|
Ingredientes: |
|
|
Bacto
triptosa |
|
|
Bacto
lactosa |
|
|
Bacto
sales biliares No. 3 |
|
|
Fosfato
dipotásico |
|
|
Fosfato
monopotásico |
|
|
Cloruro
de sodio |
|
|
Agua
destilada |
1000,0
mL |
pH
final: 6,9
Preparación:
1.
Disolver los ingredientes en un litro de agua destilada y calentar ligeramente
para que se disuelva por completo.
2.
Ajustar el pH.
3.
Distribuir en tubos de ensaye con campanas de Durham.
4.
Adicionar 10 mL de medio para cada tubo.
5.
Esterilizar en autoclave durante 15 minutos a
6.
Antes de abrir el autoclave, dejar bajar la temperatura a
Agar McConkey
|
Ingredientes: |
|
|
Proteasa
peptona o polipeptona |
|
|
Peptona
o gelizante |
|
|
Lactosa |
|
|
Sales
biliares No. 3 |
|
|
Cloruro
de sodio |
|
|
Rojo
neutro |
|
|
Cristal
violeta |
|
|
Agar |
|
|
Agua
destilada |
1000,0
mL |
pH
final: 7,1
Preparación:
1.
Disolver los ingredientes en un litro de agua destilada.
2.
Calentar hasta ebullición para disolver por completo.
3.
Ajustar el pH.
4.
Esterilizar a
5.
Enfriar a 50-
Agar Eosina Azul de Metileno de Levin (EMB-L)
|
Ingredientes: |
|
|
Peptona |
|
|
Lactosa |
|
|
K2HPO4 |
|
|
Eosina
Y |
|
|
Azul
de metileno |
|
|
Agua
destilada |
1000
mL |
pH final:
7,1 0,2
1.
Disolver la peptona, el fosfato y el agar en un litro de agua.
2.
Calentar hasta ebullición para la disolución completa.
3.
Distribuir en porciones de 100 o 200 mL y esterilizar a no más de
4.
Fundir antes de su uso y adicionar a cada porción de 100 mL:
a) 5
mL de solución de lactosa al 20%
b) 2
mL de solución acuosa de eosina al 2%
c) 4,3
mL de solución acuosa de azul de metileno al 0,15%.
Cuando
se use el producto deshidratado, disolver todos los ingredientes de acuerdo con
las instrucciones del fabricante.
Caldo Triptona al 1% (triptofano)
|
Ingredientes: |
|
|
Triptona
o tripticasa |
|
|
Agua
destilada |
1000
mL |
pH final:
6,9 0,2
1.
Disolver los ingredientes
2.
Distribuir en porciones de 5 mL en tubos de ensaye de 16 x 125 o 16 x
3.
Esterilizar a
Caldo MR-VP
Medio 1
|
Ingredientes: |
|
|
Peptona
tamponada |
|
|
Glucosa |
|
|
K2HPO4 |
|
|
Agua
destilada |
1000
mL |
pH final: 6,9 0,2
1.
Disolver los ingredientes con calentamiento suave si es necesario.
2.
Distribuir en volúmenes de 10 mL en tubos de ensaye de 16x150 mm.
3.
Esterilizar a
Caldo Citrato de Koser
|
Ingredientes: |
|
|
NaNH4HPO4
•4H2O |
|
|
KH2PO4 (monobásico) |
|
|
MgSO4 •7H2O |
|
|
Citrato
de sodio •2H2O |
|
|
Agua
destilada |
1000
mL |
pH final: 6,7 0,2.
1.
Distribuir preferentemente en tubos de ensaye con tapa de rosca.
2.
Esterilizar a
Esta
formulación se recomienda en los Métodos de Análisis Oficial de AOAC y en los
Métodos Estándares para el Análisis de Agua y Aguas de Desecho (APHA). Este
difiere de la composición del medio deshidratado disponible comercialmente y es
recomendable su uso.
B.18.3.3.4 Reactivos
Reactivo de Kovacs
|
Ingredientes: |
|
|
p-imetilaminobenzaldehído |
|
|
Alcohol
amílico (normal) |
75
mL |
|
HCI
concentrado |
25
mL |
1.
Disolver el p-Dimetilaminobenzaldehído en alcohol amílico normal.
2.
Adicionar lentamente el HCl. Almacenar a
Para la
prueba de indol
1.
Adicionar 0,2-0,3 mL del reactivo a 5 mL del cultivo de bacteria en caldo
triptona.
Se
considera una prueba positiva cuando desarrolla un color rojo en la superficie
del tubo.
Reactivo
de Voges-Proskauer (VP)
Solución 1
|
Ingredientes: |
|
|
alfa-naftol |
|
|
Alcohol
absoluto |
|
Solución 2
|
Ingredientes: |
|
|
Hidróxido
de potasio |
|
|
Agua
destilada |
para
llevar a 100 mL |
B.18.3.3.4.1 Prueba de Voges-Proskauer (VP).
1.
Transferir 1 mL del cultivo a probar con 48 horas de incubación a un tubo de
ensaye.
2.
Adicionar 0,6 mL de la solución 1 y 0,2 mL de la solución 2.
3.
Agitar después de la adición de cada solución.
4.
Para intensificar y acelerar la reacción adicionar unos cuantos cristales de
creatina y mezclar.
5.
Dejar a temperatura ambiente.
6.
Leer resultados después de 4 horas de adicionar los reactivos.
El
desarrollo de una coloración rosa es una prueba positiva.
B.18.3.3.4.2 Reactivos para la coloración de
Gram
Cristal violeta
|
Solución A |
|
|
Cristal
violeta (colorante 90%) |
|
|
Etanol
95% |
20
mL |
Solución B
|
Ingredientes: |
|
|
Oxalato
de amonio |
|
|
Agua
destilada |
80
mL |
B.18.3.3.4.3 Indicador rojo de metilo (R44)
1.
Mezclar la solución A y B. Almacenar por 24 horas
2.
Filtrar a través de un papel filtro áspero.
B.18.3.3.4.4 lodo de Gram
|
Ingredientes: |
|
|
lodo |
1g |
|
Ioduro de potasio (Kl) |
|
|
Agua destilada |
300 mL |
1.
Colocar el Kl en un mortero.
2.
Adicionar el yodo.
3.
Triturar con el pistilo por 5-10 segundos.
4.
Adicionar 1 mL de agua y triturar
5.
Adicionar 5 mL de agua y triturar
6.
Adicionar 10 mL de agua y triturar
7.
Vaciar esta solución en una botella de reactivo.
8.
Enjuagar el mortero y el pistilo con la cantidad de agua necesaria para
completar 300 mL.
B.18.3.3.4.5 Colorante de contraste (solución
concentrada)
|
Ingredientes: |
|
|
Safranina
O |
|
|
Etanol
al 95% |
100
mL |
Solución de trabajo:
Adicionar 10 mL de la solución concentrada a 90 mL de agua destilada.
B.18.3.3.4.6 Procedimiento para la tinción de
Gram:
1.
Fijar con calor moderado los frotis de la muestra a teñir.
2.
Adicionar la solución de cristal violeta al frotis.
3.
Dejar actuar por un minuto.
4.
Lavar con agua corriente y escurrir.
5.
Aplicar la solución de yodo por un minuto.
6.
Lavar con agua corriente y escurrir.
7.
Decolorar con etanol al 95% hasta que la coloración azul deje de fluir
(aproximadamente 30 segundos).
8.
Inmediatamente después enjuagar con agua corriente
9.
Escurrir.
10.
Aplicar el colorante de contraste (safranina) por 30 segundos.
11.
Enjuagar, escurrir y secar al aire. Examinar al microscopio.
Medio
EC-MUG
Preparar
el caldo EC y adicionar 50 mg de 4-metilumbelliferyl-beta-D-glucurónido (MUG)
por litro antes de esterilizar (
B.18.3.3.4.7 Procedimiento
B.18.3.3.4.8 Agua y hielo
B.18.3.3.4.9 Prueba presuntiva
B.18.3.3.3.4.10 Agitar la muestra
y transferir volúmenes de 10 mL a cada uno de 5 tubos con 20 mL de caldo lauril
sulfato triptosa de doble concentración, 5 tubos con 1 mL y 5 tubos con 0,1 mL
de caldo lauril sulfato triptosa de concentración sencilla o las siguientes
porciones: 10 tubos con 10 mL de muestra; 5 tubos con 20 mL de muestra o una
porción de 100 mL; consultar la tabla del inciso 2 en la preparación del “caldo
lauril triptosa” para la concentración de caldo lauril triptosa requerido. Los
tubos deben contener una campana de fermentación (Durham).
B.18.3.3.4.11 Incubar los tubos
a 35 0,5°C. Examinar los tubos a las 24 horas y observar si hay formación de
gas; si la formación de gas no se observa, incubar 24 horas más.
B.18.3.3.4.12 Prueba confirmativa
B.18.3.3.4.13 De cada tubo que
muestre formación de gas, tomar una asada y sembrar en un número igual de tubos
con medio de confirmación, para la determinación de bacterias coliformes
referirse al método de Determinación de bacterias coliformes. Técnica del
Número más probable, para la determinación de bacterias coliformes fecales,
sembrar en caldo EC. Inocular a dos tubos con caldo EC una cepa de E. coli como control positivo y una de Enterobacter aerogenes como control negativo e incubar con las muestras.
B.18.3.3.4.14 Para la
determinación de coliformes fecales incubar los tubos a 44,5
B.18.3.3.5 Prueba confirmativa para Escherichia coli (por
identificación bioquímica)
B.18.3.3.5.1 Tomar una asada de
cada uno de los tubos positivos y sembrar por estría cruzada en agar EMB-L para
su aislamiento.
B.18.3.3.5.2 Incubar las placas
invertidas a
B.18.3.3.5.3 Seleccionar dos
colonias de cada placa con la siguiente morfología colonial: Colonias con centro
negro, planas con o sin brillo metálico y sembrarlas en agar cuenta estándar
para realizar las pruebas de morfología microscópica y pruebas bioquímicas.
Incubar las placas a
B.18.3.3.5.4 Si no hay colonias
con morfología típica, probar una o más colonias lo más parecido E. coli de cada placa.
B.18.3.3.5.5 Hacer un frotis y
teñirlo por Gram. Observar al microscopio la presencia de bacilos cortos o
cocobacilos Gram-negativos.
B.18.3.3.6 Pruebas Bioquímicas Indol, Rojo de
metilo, Voges Proskauer, Citrato (IMViC).
a. Producción de indol
Inocular
un tubo en caldo triptona e incubarlo a
b.
Voges-Proskauer (VP)
Inocular
un tubo con caldo MR-VP e incubar a
c. Rojo de metilo
Inocular
un tubo adicional con caldo MR-VP e incubar a
d. Citrato
Inocular
un tubo con caldo citrato de Koser un inóculo ligero para evitar turbiedad en
el tubo. Incubar a
e. Interpretación de resultados
Todos
los cultivos que: 1. Fermenten la lactosa con producción de gas dentro de las
48 horas a
Biotipo
1--, o Biotipo 2---, son consideradas como E.
coli. Calcular el NMP de E. coli
basada en la proporción de los tubos positivos de caldo EC.
B.18.3.3.7 Prueba Confirmativa para Escherichia coli (por el método de EC-MUG)
Fundamento.
Alrededor
del 94% de las cepas de E. coli
incluso las cepas no productoras de gas producen la enzima beta-glucuronidasa
(GUD), la cual rompe el sustrato específico
4-metilumbelliferyl-beta-D-glucurónido (MUG) en 4-metilumbelliferona (MU), que
al ser expuesto a una fuente de luz ultravioleta (UV) de onda larga (365 nm)
produce una fluorescencia azul, fácil de observar. Cuando el MUG es incorporado
al caldo EC se puede identificar E. coli.
B.18.3.3.8 Seguir lo indicado para Prueba
Presuntiva
B.18.3.3.9 Prueba Confirmativa
De
cada tubo que muestre formación de gas, tomar una asada y sembrar en un número
igual de tubos con medio de confirmación EC-MUG. Inocular dos tubos con caldo
EC-MUG una cepa de E. coli como
control positivo y K. pneumoniae como
control negativo. Incubar a estos tubos con uno adicional de caldo EC-MUG sin
inocular a 44,5
B.18.3.3.10 Alimentos
B.18.3.3.10.1 Prueba Presuntiva.
B.18.3.3.10.2 Preparar la muestra
como se indica en el método Preparación y dilución de muestras de alimentos
para análisis microbiológico; y de acuerdo con el tipo de producto, utilizar
las diluciones apropiadas, según se indica en el procedimiento de la densidad
microbiana por la técnica del número más probable.
Utilizar
como medio de enriquecimiento caldo lauril triptosa y continuar como anteriormente
B.18.3.3.10.3 Prueba Confirmativa.
Continuar como anteriormente
B.18.3.3.10.4 Prueba Confirmatoria.
Confirmar
la presencia de Escherichia coli en
por lo menos el 10% de las pruebas con resultados positivos a coliformes
fecales por cultivo en placas de agar McConkey a partir de los tubos que
demostraron la presencia de gas en la prueba confirmativa. Incubar las placas a
35
B.18.3.3.11 Interpretación de Resultados.
La
formación de gas en el tubo de fermentación secundario dentro de las 48 3 horas
y la demostración de bacilos Gram (-) no esporulados confirma un resultado
positivo de la prueba demostrándose la presencia del grupo coliforme.
B.18.3.3.12 Cálculos
Calcular
la densidad microbiana en número más probable conforme al procedimiento
señalado anteriormente, para estimar la población de bacterias coliformes y
bacterias coliformes fecales de acuerdo con las diluciones empleadas y expresar
en NMP/g o mL para alimentos y NMP/100 mL para agua. En el caso de usar
volúmenes de 20 mL de muestras de agua en 5 tubos o 10 mL de muestras de agua
en 10 tubos, utilizar las siguientes tablas:
TABLA 1. Indice del NMP con 95% de límite de
confianza para varias combinaciones de resultados positivos y negativos cuando
se usan 5 tubos con 20 mL de muestra de agua o hielo.
|
No. de Tubos |
|
95% de Límite de Confianza (aproximado) |
|
|
Positivos |
NMP/100
mL |
Inferior |
Superior |
|
0 |
1,1 |
0 |
3,0 |
|
1 |
1,1 |
0,05 |
6,3 |
|
2 |
2,6 |
0,3 |
9,6 |
|
3 |
4,6 |
0,8 |
14,7 |
|
4 |
8,0 |
1,7 |
26,4 |
|
5 |
8,0 |
4,0 |
Infinito |
TABLA 2. Indice del NMP con 95% de límite de
confianza para varias combinaciones de resultados positivos y negativos cuando
se usan 10 tubos con 10 mL de muestra de agua o hielo.
|
No.
de Tubos Positivos |
NMP/100
mL |
95% de Límite de Confianza (aproximado) |
|
|
Inferior |
Superior |
||
|
0 |
1,1 |
0,0 |
3,0 |
|
1 |
1,1 |
0,03 |
5,9 |
|
2 |
2,2 |
0,26 |
8,1 |
|
3 |
3,6 |
0,69 |
10,6 |
|
4 |
5,1 |
1,3 |
13,4 |
|
5 |
6,9 |
2,1 |
16,8 |
|
6 |
9,2 |
3,1 |
21,1 |
|
7 |
12,0 |
4,3 |
27,1 |
|
8 |
16,1 |
5,9 |
36,8 |
|
9 |
23,0 |
8,1 |
59,5 |
|
10 |
23,0 |
13,5 |
Infinito |
B.19
Determinación de Humedad en leche, fórmula láctea y producto lácteo combinado,
sometidos a deshidratación.
B.19.1
Principio del Método.
Este método se basa en la pérdida de peso
debido a la evaporación del agua bajo condiciones establecidas.
B.19.2
Equipo.
B.19.2.1 Balanza analítica con sensibilidad de 0, 1
mg.
B.19.2.2 Estufa eléctrica con regulador de
temperatura a 100 – 102º C.
B.19.3
Materiales.
B.19.3.1
Desecador de vidrio con
sílica gel con indicador de humedad u otro desecante activo.
B.19.3.2
Cápsulas de vidrio, acero
inoxidable, níquel o aluminio de
B.19.3.3
Pinzas metálicas especiales
para las cápsulas.
B.19.4
Procedimiento.
B.19.4.1
Preparación de
B.19.4.1.1 Cuando se tome la muestra operar tan rápido
como sea posible. Evitar la absorción de humedad del medio ambiente durante la
preparación de la muestra. Mezclar el producto transfiriéndolo a un frasco seco
y bien tapado con capacidad aproximada al doble del tamaño de la muestra.
Mezclar cuidadosamente agitando e invirtiendo repetidamente.
B.19.4.1.2 Sólo para muestras que presentan grumos o
terrones, tamizar la muestra a través de una malla número 20 y si es necesario
frotar el material a través de la malla y golpear vigorosamente.
B.19.4.2
Preparación de las Cápsulas.
Secar las cápsulas destapadas en una estufa
controlada a 100-
B.19.4.3
Secado de las Muestras.
En las cápsulas previamente secadas y
pesadas, pesar con exactitud y distribuir homogéneamente de
B.19.5
Cálculos.
% de Humedad ![]()
En donde:
mo = masa en gramos de la cápsula y la tapa.
m1 = masa en gramos de la cápsula
y tapa con la muestra antes de secar.
m2 = masa en gramos de la cápsula y la tapa con la muestra después de
secar.
B.19.6 Expresión
de Resultados.
|
% Humedad |
B.20.
Determinación de Clostridium botulinum
y sus Toxinas en Alimentos y Muestras Clínicas
B.20.1
Fundamento
Demostrar la presencia de toxina botulínica
por inyección a ratones con extractos de alimentos o muestras clínicas y
observar el efecto letal. Comprobar con el antisuero específico la
neutralización de la toxina. La determinación de C botulinum se basa en el
cultivo de muestras de alimentos y clínicas en condiciones de anaerobiosis en
medios específicos y la subsecuente demostración de la toxina.
20.2 Toma y manejo de muestras
B.20.2.
Alimentos
Las muestras pueden tomarse de sobrantes de
los alimentos sospechosos o de recipientes cerrados. Cuando están involucrados
alimentos comerciales, es importante observar la etiqueta, número de lote del
fabricante, o cualquier dato relevante que pueda identificar el origen de la
muestra.
B.20.2.2 Clínicas
Las muestras clínicas para el análisis
incluyen: materia fecal, aproximadamente
B.20.3
Envío de muestras
B.20.3.1 Para un envío seguro, el interior de los
empaques deben contener:
(i) Un primer recipiente impermeable al agua.
(ii) Un segundo recipiente impermeable al
agua.
(iii) Material absorbente (por ejemplo
unicel) entre los dos contenedores, suficiente para absorber el contenido
entero del primer recipiente.
B.20.3.2 De preferencia enviar el material en
refrigeración en paquetes que contengan recipientes con gel congelado. Para una
máxima preservación de la toxina el recipiente secundario debe empacarse en una
caja de unicel con recipientes de gel congelado. Sin embargo, si se sospecha
retraso en el envío, el material debe congelarse y empacarse con hielo seco.
B.20.4 Materiales, Equipo y Reactivos
B.20.4.1 Flujo laminar
B.20.4.2 Propipeta o bulbo
B.20.4.3 Lentes de seguridad
B.20.4.4 Guantes de cirujano
B.20.4.5 Tubos de centrífuga de 40 mL de
capacidad
B.20.4.6 Centrífuga refrigerada con capacidad
de 15 000 x g
B.20.4.7 Jeringas desechables de 19 x 15.
B.20.4.8 Filtros desechables de 0,45ú m.
B.20.4.9 Vortex
B.20.4.10 Licuadora
B.20.4.11 Potenciómetro
B.20.4.12 Incubadora 30º,
B.20.4.13 Balanza
B.20.4.14 Tubos de ensayo de 13 x
B.20.4.15 Jeringas para tuberculina
B.20.4.16 Equipo para tinción de Gram
B.20.4.17 Ratones de preferencia hembras de
B.20.4.18 Antisuero trivalente ABE
B.20.4.19 Antisuero monovalente A,B,E y F
B.20.4.20 Tripsina al 1% p/v
B.20.4.21 Tripsina al 1,4%
B.20.4.22 Solución reguladora de fosfatos con
gelatina
B.20.4.23 Solución de tetraciclina al 0,2%
B.20.4.24 0,1 N NaOH o NaHCO3 saturado para
limpiar posibles derrames.
B.20.4.25 Tripsina al 1% p/v
B.20.4.26 Tripsina al 1,4%
B.20.4.27 Medio carne cocida (CMM)
B.20.4.28 Caldo tripticasa peptona glucosa
extracto de levadura (TPGY).
B.20.4.29 Caldo tripticasa peptona glucosa
extracto de levadura (TPGYT) con tripsina
B.20.4.30 Agar aislamiento Clostridium botulinum (CBI)
B.20.4.31 Agar hígado de ternera yema de
huevo
B.20.4.32 Agar esporulación de Eklund
B.20.4.33 Baño de agua (75-
B.20.4.34 Etanol al 50% o absoluto
B.20.4.35 Jarras y sistema de anaerobiosis
B.20.5
Preparación de Medios de Cultivo
B.20.5.1 Medio
de
FORMULA
Corazón de res
Proteosa peptona
Bactodextrosa
Cloruro de sodio
Extracto de corazón de res 1000 mL
Picar el corazón de res, sumergir en agua y
calentar hasta ebullición durante 1 h. Enfriar, ajustar el pH a 7,0, y hervir
10 minutos. Filtrar a través de muselina y presionar para drenar el exceso de
líquido de la carne. Guardar la carne cocida. Agregar los ingredientes al
filtrado y ajustar a pH 7,0, agregar agua hasta hacer 1000 mL. Filtrar a través
de papel filtro poroso. Se puede conservar el caldo y la carne en congelación
por separado. Agregar el corazón cocido y picado a tubos de ensaye de 18 x
B.20.5.2 Caldo
Tripticasa Peptona Glucosa Extracto de Levadura (TPGY).
FORMULA
Tripticasa
Peptona
Glucosa
Extracto de levadura
Tioglicolato de sodio
Agua destilada 1000 mL
Disolver los ingredientes en agua caliente,
enfriar y ajustar a pH 7,2. Distribuir en volúmenes de 21 mL en tubos de 20 x
B.20.5.3 Caldo
Tripticasa Peptona Glucosa Extracto de Levadura adicionado con Tripsina
(TPGYT).
FORMULA
Tripticasa
Peptona
Glucosa
Extracto de levadura
Tioglicolato de sodio
Agua destilada 1000 mL
Disolver los ingredientes en agua caliente,
enfriar y ajustar a pH 7,2. Distribuir en volúmenes de 21 mL en tubos de 20 x
B.20.5.4 Agar
Hígado de Ternera Yema de huevo.
a)
Agar Hígado de ternera.
FORMULA
Infusión de hígado
Infusión de ternera
Proteosa peptona
Neopeptona
Triptona
Dextrosa
Almidón soluble
Caseína isoeléctrica
Cloruro de sodio
Nitrato de sodio
Gelatina
Agar
Agua destilada 1000 mL
Calentar con agitación constante hasta
dilución completa. Esterilizar en autoclave por 15 minutos a
b)
Emulsión al 50% de Yema de huevo.
Lavar los huevos con un cepillo suave y dejar
escurrir. Sumergirlos por 1 hora en solución de cloruro mercúrico al 0,1%,
escurrir. Sumergir en una solución de etanol al 70% y dejar durante 30 minutos,
escurrir. Abrir los huevos en condiciones asépticas y descartar las claras.
Colocar las yemas en un recipiente estéril y mezclar con igual volumen de
solución salina fisiológica (0,85%) estéril. Guardar en refrigeración hasta su
uso.
B.20.5.5
Agar para Asilamiento de C. botulinum (CBI).
El agar CBI es una modificación del medio
agar McClung Toabe para el aislamiento selectivo y diferencial de C. botulinum,
el cual puede aislarse de los cultivos toxigénicos de CMM, provenientes de
muestras de heces, líquido gástrico o alimentos. El medio de agar CBI contiene:
Cicloserina 250 mg/ mL,
sulfametoxazol 76 mg/ mL y trimetroprim 4 mg/ mL en la base del medio agar McClung Toabe yema de huevo.
Agar McClung Toabe
FORMULA
Proteosa peptona
Bacto dextrosa
Fosfato de sodio dibásico
Fosfato de potasio monobásico
Cloruro de sodio
Sufato de magnesio
Agar
Agua destilada 1000 mL
pH final 7,6 +
Extracto de levadura
Suspensión de yema de huevo 100 mL
SOLUCION DE ANTIBIOTICOS
Cicloserina 250 mg o 25 mL de una solución al
1,0%
Sufametoxasol 76 mg o 4 mL de una solución al
1,9%
Disolver el sulfametoxazol en solución 2 N de
NaOH.
Lactato de Trimetroprim 4 mg o 4 mL de una
solución al 0,1% por cada 100 mL de medio base
Esterilizar por filtración.
Preparación:
Agregar el extracto de levadura y los
ingredientes del agar McClug Toabe a un matraz de
B.20.5.6
Agar para Esporulación de Eklund.
FORMULA
Tripticasa
Peptona
Glucosa
Extracto de levadura
Agar
Agua destilada 200 mL
Disolver los ingredientes en agua caliente,
excepto el agar, ajustar a pH 7,8, agregar el agar. Esterilizar a 121±1ºC/15
min. y enfriar a
B.20.6 Diluyentes
y Reactivos
B.20.6.1 Solución
Amortiguadora de Fosfatos con Gelatina
FORMULA
Gelatina
Na2HPO4
Agua destilada 1000 mL
Ajustar a pH 6,2 con solución de ácido
clorhídrico 4N. Distribuir en frascos con tapón de rosca, esterilizar por
vapor, enfriar a la temperatura ambiente y almacenar a
B.20.6.2
Solución de Tetraciclina al 0,2%.
Disolver 50 mg en 25 mL del diluyente fosfato
de gelatina, mantener a
B.20.6.3
Solución de Tripsina (1:250).
a) Solución al 1%
Disolver 200 mg en 20 mL de agua destilada.
No almacenar.
b) Solución al 1,4%.
Disolver 280 mg en 20 mL del diluyente
fosfato de gelatina, filtrar a través de membrana de 0,45 ú m. Usar vacío para obtener efecto parcial de
deareación del filtrado.
B.20.6.4 Antisueros
A, B, E; A, B; A, B, E, C*, D*, F.
Investigación de sospecha de botulismo en
animales.
B.20.7
Procedimiento
B.20.7.1
Examen Microscópico de los Alimentos Sospechosos
Este examen no es esencial para la detección
de C. botulinum, pero facilita la selección de los alimentos sospechosos
para el análisis. Preparar frotis directos y hacer tinción de Gram. Si el
alimento contiene exceso de grasa, sumergir los portaobjetos fijados al calor
por 1-2 minutos en xilol antes de teñir.
B.20.7.2
Preparación del Material para el Análisis de las Toxinas.
B.20.7.2.1 Alimentos
Líquidos:
Centrifugar aproximadamente 20 mL a 15000 x g
durante 20 minutos. Decantar cuidadosamente el sobrenadante o extraer con una
jeringa desechable de 19 x
B.20.7.2.2
Alimentos Semilíquidos:
Colocar 10-
Centrifugar y proceder como en B.20.7.2.1.
B.20.7.2.3
Alimentos Sólidos:
Colocar 10-
B.20.7.2.4
Alimentos Enlatados:
Lavar y secar la superficie de la lata.
Cubrir la tapa con etanol al 96%, dejar por 2 minutos; decantar y flamear el
alcohol residual. Colocar la lata en una bolsa de plástico para prevenir la
dispersión de aerosoles y abrir con un abrelatas estéril. Proceder como en
B.20.7.2.1, B.20.7.2.2 y B.20.7.2.3.
B.20.7.2.5
Suero
Idealmente debe obtenerse 10 mL de suero. El
suero usado sirve sólo antes del tratamiento con el antisuero. Si está turbio,
centrifugar a 15,000 x g durante 20 minutos, decantar el sobrenadante.
B.20.7.2.6
Heces
Colocar
Ocasionalmente, los sobrenadantes de muestras
clínicas no se pueden filtrar, en estos casos, agregar 1 mL de una solución al
0,2% de tetraciclina por cada 9 mL del sobrenadante.
B.20.7.2.8 Contenido
Gástrico
Medir el pH y ajustar, si es necesario, a
5,5-6,5 con una solución 1N de NaOH. Evitar que el valor de pH sea mayor a 7,0.
Centrifugar y proceder como en B.20.7.2.1.
B.20.7.2.9
Otras Muestras Clínicas.
Tratar las muestras semilíquidas y sólidas
como en B.20.7.2.2 y B.20.7.2.3
B.20.8 Análisis
de las toxinas
B.20.8.1
Procedimiento General (se
aplica cuando no se sospecha de alguna toxina en particular).
B.20.8.1.1 Si se dispone de suficiente material,
distribuir el filtrado en volúmenes de 1,2 mL dentro de 6 tubos de ensaye de 13
x
B.20.8.1.2 Al tubo 6, agregar 0,12 mL de una solución
de tripsina al 1%. Incubar a
B.20.8.1.3 Si el volumen de material es insuficiente
para completar la prueba, se puede omitir el tubo No. 6.
B.20.8.1.4 Inyectar dos ratones (20-
B.20.8.1.5 Si mueren 1 o 2 ratones repetir la
inyección. Una muestra se considera positiva para la toxina si 2/2 o > o =
2/4 ratones mueren, si se presenta la muerte de los animales dentro de las 2
primeras horas se pueden considerar que son debidas a otras causas diferentes a
toxina botulínica.
B.20.8.1.6 Si solamente mueren los ratones inoculados
con las muestras tratadas con tripsina, indica la presencia de toxina de grupo
II y continuar como se indica en el punto B.20.8.3.
B.20.8.1.7 Si no se neutralizara la toxina con los
antisueros A, B y E, indica
a) la presencia de toxinas no relacionadas en
especial cuando se presentan síntomas atípicos;
b) Cantidad insuficiente de antisuero en
presencia de altos niveles de toxina (difícil en caso de muestras clínicas y en
la mayoría de los alimentos tóxicos; o
c) incluido un serotipo no común. Si la muestra
probada produce síntomas típicos de botulismo y sin embargo no es neutralizada
con los antisueros, proceder de la forma siguiente:
i) En casos de muy alta toxicidad, diluir la
muestra 1:10 con solución amortiguadora de fosfatos gelatina y repetir la
prueba de neutralización.
ii) Incluir el antisuero F en la prueba de
neutralización.
B.20.8.2 Muestras
Sospechosas de contener Toxina Grupo V (A o B).
Proceder como se indica anteriormente
omitiendo el tubo No. 6.
B.20.8.3
Muestras Sospechosas de contener Toxina Grupo II (B o E).
Distribuir en cada uno de los tubos marcados
del 1 al 4, 1,2 mL del filtrado. A cada tubo agregar 0,12 mL de una solución de
tripsina al 1%, incubar a
Si no hubiese material disponible suficiente,
omitir los tubos con los antisueros monovalentes B y E.
B.20.8.4
Determinación de
Si se quiere titular la toxina, hacer
diluciones decimales de los sobrenadantes tratados, y no tratados con tripsina,
generalmente se hacen hasta 1:1000 dependiendo del nivel de toxina esperado,
pero nunca excediendo 1:10000. Inyectar 2 ratones por dilución. La recíproca de
la dilución más alta que causa la muerte multiplicada por 2, es
B.20.9 Identificación
de Clostridium botulinum.
B.20.9.1
Quitar el exceso de aire
disuelto en los tubos preparados con medio caldo carne cocida (CMM) y caldo
glucosa peptona tripticasa extracto de levadura (TPGY), mediante calentamiento
en baño de agua a ebullición por 10 minutos y enfriar antes de usarlos.
Asegurarse de que las tapas de los tubos estén flojas al hacer este proceso.
B.20.9.2 Agregar a los tubos de TPGY 1,5 mL de una
solución de tripsina al 1,4% y mezclar suavemente y marcar con una T (TPGYT). A
los tubos de CMM marcarlos con 1 y 2; y 3 y
B.20.9.3 Cualquier tipo de muestra incluyendo los
sedimentos, pueden servir como inóculo; éstos además tienen la ventaja de que
no contienen inhibidores potenciales, los cuales se han eliminado junto con el
sobrenadante, de aquí que los sedimentos pueden contener grandes cantidades de
microorganismos por unidad de volumen.
B.20.9.4 Colocar aproximadamente
B.20.9.5 Para seleccionar esporas sensibles o
resistentes al calor, suspender aproximadamente
B.20.9.6
Incubar los tubos a
B.20.9.7 Si fuera necesario neutralizar con antisuero
tipo F, el cual es relativamente débil, determinar la toxicidad y diluir con
solución amortiguadora de fosfatos de gelatina el sobrenadante a aproximadamente
10 DLR/mL. Mezclar volúmenes de 1,25 mL con 0,25 mL de antisuero F. Inyectar
0,5 mL sin antisuero y 0,6 mL con antisuero.
B.20.10
Aislamiento de Clostridium botulinum a partir de Cultivos
Toxigénicos.
B.20.10.1 El aislamiento de cepas productoras de
botulismo, se facilita si se dan todas las condiciones para la producción de
toxina. Si los cultivos de los tubos Nos. 2 o 4 son toxigénicos, uno de éstos
debe seleccionarse. Sembrar directamente en agar hígado de ternera yema de
huevo o en agar para el aislamiento de Clostridium
botulinum (CBI), en estos medios no
se ha observado un enmascaramiento por microflora atípica. En el caso de que
predominara flora atípica combinada con la presencia de algunas esporas de C. botulinum,
el inóculo debe hacerse previo tratamiento con etanol. En el caso de ausencia
de esporas, reincubar los tubos de enriquecimiento o pasar al medio de
esporulación (Eklund).
B.20.10.2
Aislamiento de C. botulinum de Cultivos con Presencia
Moderada de Microorganismos Atípicos.
B.20.10.2.1 Hacer una tinción de Gram de los cultivos
tóxicos. Si los cultivos 2 y 4 son tóxicos, pueden excluirse los tubos 1 y 3.
Seleccionar los cultivos sobre las siguientes bases:
i) Bacilos gram positivos atípicos.
ii) Número de bacilos gram positivos con esporas.
Si en la tinción se observa un mínimo de 10% de bacilos gram positivos,
inocular una asada en agar hígado de ternera-yema de huevo y en agar CBI.
Incubar en anaerobiosis a
NOTA: Es importante tomar en cuenta que
cultivos viejos de C. botulinum pueden aparecer como Gram
negativos.
B.20.10.2.2 Seleccionar 5 colonias bien aisladas sobre
el agar hígado de ternera yema de huevo que presenten un halo opaco indicativo
de lipolisis y pasarlas a caldo TPGY. Seleccionar otras 5 colonias del medio
agar para el aislamiento de C. botulinum rodeadas de un halo opaco con
brillo aperlado y pasar a caldo TPGY. Incubar a
B.20.10.3
Aislamiento de C. botulinum de Cultivos con Grandes
Cantidades de Microorganismos Atípicos.
B.20.10.3.1 Si en la tinción de Gram se observan bacilos
gram positivos con esporas, mezclar 2 mL del cultivo, con 2 mL de etanol al
96%, y dejar a temperatura ambiente por 60 minutos. Inocular una asada en agar
hígado de ternera yema de huevo y en agar aislamiento de C. botulinum, y continuar
como se indica en B.20.10.1
B.20.10.3.2 Si no se presenta esporulación en el medio
de enriquecimiento, reincubar por otra semana a
TABLA No. 1 ALGUNAS
CARACTERISTICAS DE C. BOTULINUM GRUPOS I Y II
|
GRUPO
CRECIMIENTO POR ABAJO DE |
TEMPERATURA
PARA CRECIMIENTO Y PRODUCCION DE TOXINA |
|
|
|
|
|
I |
A,B, Fb |
+ |
+ |
- |
30
- |
|
II |
Bc,E,F
b |
+ |
- |
+ |
26
- |
* Algunas cepas de los tipos A y B pueden presentar
subtipos A-B, A-F. B-A. B-F, cada una produce una toxina en mayor cantidad
(representada por la primera letra del subtipo).
b No común
c No común en Norteamérica
TABLA No. 2 PRUEBA DE
NEUTRALIZACION Y TOXICIDAD EN RATON
|
TUBO
No. |
Volumen
de muestra (mL) |
Antisuero |
Volumen
del Antisuero ( mL) |
Volumen
iunoculado ( mL) |
|
1 |
1,2 |
- |
- |
0,5 |
|
2 |
1,2 |
AntiA |
0,12 |
0,55 |
|
3 |
1,2 |
AntiB |
0,12 |
0,55 |
|
4 |
1,2 |
AntiE |
0,12 |
0,55 |
|
5 |
1,2 |
Anti
A,B,E |
0,12 |
0,55 |
|
6 |
1,2 |
Tripsina |
0,12 |
0,55 |
TABLA No 3 ENRIQUECIMIENTO
|
TUBO
No. |
MEDIO |
TRATAMIENTO |
|
1 |
CMM |
NINGUNO |
|
2 |
CMM |
CALOR |
|
3 |
TPGYT |
NINGUNO |
|
4 |
TPGYT |
ALCOHOL |
B.21.
Determinación de Acidez en Cremas y Productos Lácteos Fermentados y
Acidificados
B.21.1 Principio
del Método.
La acidez se mide con base a una titulación
alcalimétrica con NaOH 0.1 N utilizando fenolftaleína como indicador.
B.21.2 Equipo.
B.21.2.1
Potenciómetro (opcional)
B.21.2.2
Balanza analítica con una
precisión de 0,1 mg.
B.21.2.3
Agitador magnético
B.21.3
Materiales.
B.21.3.1 Probeta graduada de 100 mL.
B.21.3.2 Pipeta volumétrica de 9 mL (estándar
para crema).
B.21.3.3 Matraz Erlenmeyer de 125 mL
B.21.3.4 Bureta de 25 o 50 mL graduada en 0.1
mL.
B.21.3.5 Barra magnética (opcional).
B.21.4 Reactivos.
Todos los reactivos deben ser grado analítico
a menos que se indique otra especificación y por agua se entiende agua
destilada recientemente hervida.
B.21.4.1 Solución de hidróxido de sodio (NaOH) 0.1 N
valorada.
B.21.4.2
Solución indicadora de
fenolftaleína (C29H14O4) al 1%.
B.21.5
Procedimiento.
B.21.5.1 Medir 9 mL (si se emplea la pipeta estándar
de crema) o pesar
B.21.5.2
Si la muestra es pesada,
añadir 2 veces el peso de la misma en agua y mezclar bien.
B.21.5.3
Adicionar 0.5 mL de
indicador de fenolftaleína y titular con solución de hidróxido de sodio 0.1 N
hasta la aparición de un color rosa permanente por lo menos 30 segundos (se
recomienda emplear siempre una cantidad constante de indicador ya que su
concentración puede influir en los resultados).
B.21.5.4 Si la muestra es obscura o colorida, será
necesario después de agregar agua, titular con ayuda de un potenciómetro a un
pH de 8.3.
B.21.5.
Cálculos
%Acidez(expresada como ácido
láctico) = (VxNx9)/M
donde:
V = mL de NaOH 0.1 N gastados en la
titulación.
N = Normalidad de la solución de NaOH
M = Volumen o peso de la muestra.
B.21.7
Expresión de resultados.
|
% Acidez titulable expresada como ácido
láctico |
B.22.
Determinación de Vitamina A por Cromatografía Líquida de
Alta Resolución (HPLC en fase reversa).
B.22.1
Principio del método.
Los lípidos son ésteres que en presencia de
un álcali cáustico se hidrolizan liberando el material insaponificable, el cual
es extraído con un disolvente orgánico. Posteriormente la vitamina A contenida
en este material, es cuantificada por medio de Cromatografía de Líquidos de
Alta Resolución.
B.22.2
Equipo.
B.22.2.1. Sistema
de HPLC que incluye:
B.22.2.1.1 Bomba binaria LC. ( se puede
contar con una trinaria o cuaternaria)
B.22.2.1.2 Inyector automático o manual de
muestras.
B.22.2.1.3 Detector espectrofotométrico de
longitud de onda variable UV-Visible LC.
B.22.2.1.4 Integrador computarizado LC.
B.22.2.1.5 Columna Octadecil ODS (20), tamaño
de partícula 5, longitud
B.22.2.1.6 Balanza analítica, con capacidad
de
B.22.2.1.7 Placas de agitación con
calentamiento.
B.22.2.1.8 Cilindro para gas
comprimido de nitrógeno pureza 95%.
B.22.2.1.9 Cilindro para gas comprimido de helio
pureza 95%.
B.22.2.1.10 Evaporador rotatorio con elevador rápido y baño maría.
B.22.2.1.11 Equipo de filtración para la
preparación de la fase móvil.
B.22.2.1.12 Cronómetro o reloj.
B.22.3
Materiales.
B.22.3.1 Matraces volumétricos actínicos o de
color marrón con tapón de vidrio o teflón de 50 y 100 mL.
B.22.3.2 Matraces actínicos o de color marrón
de fondo plano, cuello corto de 250 mL.
B.22.3.3 Matraces, en forma de pera actínicos
o de color marrón, de cuello corto y boca esmerilada de 500 mL (que embone en
el rotavapor). Si no se contaran con estos, se pueden utilizar matraces de
fondo plano.
B.22.3.4 Matraces volumétricos actínicos o de
color marrón de 10 mL.
B.22.3.5 Vasos de precipitados de 500 mL.
B.22.3.6 Embudo de separación cónico,
actínicos o de color marrón, con llave de teflón 500 mL.
B.22.3.7 Embudo tallo corto diámetro
B.22.3.8 Tapones de teflón huecos hexagonales
o actínicos o de color marrón.
B.22.3.9 Refrigerante con macho y hembra,
manguito 300 mL, de
B.22.3.10 Manguera de látex.
B.22.3.11 Papel filtro mediano No. 1 con
diámetro de
B.22.3.12 Pipetas volumétricas con marca de 5
y 4 mL.
B.22.3.13 Jeringa de vidrio sin aguja
desechable de 10 mL. Se pueden utilizar jeringas plásticas sin aguja
desechables de 10 mL.
B.22.3.14 Filtros para jeringa (acrodiscos
para HPLC) de 0,45 m de tamaño de poro y diámetro de
B.22.3.15 Membranas de filtración de fluoruro
de polivinilideno, utilizada para fases móviles (solventes orgánicos y
acuosos), cuyos extractables sean de absorción en UV, u otro filtro para fines
similares.
B.22.3.16 Magnetos para placa de agitación.
B.22.4
Reactivos.
B.22.4.1 Los reactivos que a continuación se
mencionan deben ser grado analítico y por agua debe entenderse agua destilada.
B.22.4.2 Estándar de retinol (vitamina A)
cristalizada (C20H30O) all trans RETINOL con certificado de
pureza.
B.22.4.3 Hidróxido de potasio en lentejas
(KOH).
B.22.4.4 Alcohol etílico absoluto (C2H5OH).
B.22.4.5 Eter de petróleo intervalo de
ebullición 40 -
B.22.4.6 Fenolftaleína en solución etanólica
al 1%, indicador ( C20H14O4).
B.22.4.7 Metanol grado HPLC (CH3OH).
B.22.4.8 Agua destilada filtrada, grado HPLC
(sólo para la preparación de fase móvil).
B.22.4.9 Agua destilada que se utilizará en
los lavados del saponificado (verificar que el valor de pH no sea mayor de
6,0).
B.22.4.10 Sulfato de sodio
anhidro (Na2SO4).
B.22.4.11 Acido ascórbico (C6H8O6).
B.22.4.12 Fase móvil metanol: agua (95:5)
para HPLC.
Pasar agua destilada a través de una membrana
de filtración para soluciones acuosas. Pasar metanol a través de una membrana
de filtración para solventes orgánicos. Posteriormente mezclar 50 mL de agua
destilada en 950 mL de metanol (fase móvil). Degasificar la fase móvil pasando
una ligera corriente de gas helio o por ultrasonido 15 minutos a temperatura
ambiente. Si el equipo cuenta con desgasificador integrado, permitir que la
mezcla la realice el mismo.
B.22.4.12
Soluciones Patrón de Vitamina A. Siempre y cuando se garantice la estabilidad de la misma, a través de
un controlado en un Gráfico de Factor de Respuesta.
B.22.4.12.1
Solución Concentrada (150 g equivalentes de retinol).
Justo antes de emplearse, pesar 15 mg de
retinol cristalizado (A - OH) y registrar el peso exacto. Colocar el estándar
pesado en un matraz volumétrico de 100 mL. Disolver con metanol y llevar al
volumen.
B.22.4.12.2
Solución Intermedia (15 g equivalentes de retinol).
Diluir 5 mL de la solución concentrada a 50
mL con el mismo metanol para obtener una solución de aproximadamente 50 UI/mL.
B.22.4.12.3
Solución de Trabajo (6 g equivalentes de retinol).
Añadir 4 mL de la solución estándar
intermedia al matraz marcado como estándar y adicionar los reactivos al igual
que al blanco y muestra como se indica en el apartado de saponificación. Esta
solución tendrá aproximadamente 20 UI/mL de vitamina A, al final del proceso de
recuperación, en el matraz volumétrico de 10 mL.
Nota
1: Si el certificado de % de
pureza en el estándar es inferior al 85% no debe prepararse la solución patrón,
siendo necesario un nuevo estándar de otro lote con una pureza superior a la
antes indicada.
Nota
2: La vitamina A-OH
(A-alcohol) se oxida con gran rapidez y es muy sensible a la luz. Al abrir una
ampolleta nueva de vitamina A-cristalizada, pesar la cantidad de estándar
requerida y guardar la ampolleta bajo atmósfera de nitrógeno o en condiciones
similares.
B.22.5
Procedimiento
Nota
3: La vitamina A es sensible
a la luz. Utilizar material actínico o de color marrón o bien, proteger el
material con papel aluminio. Por otra parte, efectuar las evaporaciones con
rotavapor a una temperatura máxima de
B.22.5.1
Toma de Muestra.
En el caso de productos deshidratados,
reconstituir con agua, de acuerdo con las instrucciones señaladas en la
etiqueta o
Medir de preferencia por duplicado una
cantidad de muestra tal, que contenga de
B.22.5.2
Saponificación.
B.22.5.2.1 Marcar 4 matraces actínicos de cuello corto
y esmerilado con fondo plano de 250 mL (cuando la muestra se trabaje por
duplicado) de la siguiente manera: blanco, estándar y muestra.
B.22.5.2.2 Añadir los siguientes reactivos a cada uno
de los matraces antes mencionados:
B.22.5.2.3 Montar un sistema de reflujo y calentar
durante 30 minutos en placas de calentamiento o baño de agua en ebullición con
agitación constante.
Nota
4: Durante la
saponificación, asegurar una buena agitación del medio de reacción.
B.22.5.3 Extracción
del Insaponificable.
B.22.5.3.1
Una vez concluido el tiempo
de saponificación, enjuagar con máximo 30 mL de agua destilada (evitar el
exceso de agua para prevenir la formación de emulsiones) por las paredes
internas del refrigerante sin quitar el matraz del saponificado. Enfriar el
matraz aun instalado al refrigerante sumergiéndolo parcialmente en un vaso de
precipitados que contenga agua fría, lo anterior con la finalidad de llevarlo a
temperatura ambiente, evitando enfriarlo demasiado. Trasvasar la suspensión a
un embudo de separación de 500 mL.
B.22.5.3.2
Enseguida enjuagar el matraz
con 100 mL de éter de petróleo que se añaden al embudo de separación. Extraer
la vitamina A agitando ligeramente. Dejar separar las fases. Vaciar la fase
acuosa a otro embudo de 500 mL. Recoger la fase orgánica a un tercer embudo de
separación de 500 mL. Repetir la operación dos veces más, enjuagando el matraz
con dos porciones de 100 mL de éter cada una.
B.22.5.3.3
Efectuar esta extracción 3
veces en total (un lavado de 50 mL y 2 lavados de 100 mL). Hacer las
agitaciones con mucho cuidado para evitar emulsiones.
B.22.5.3.4
Lavar la solución orgánica
con porciones de 100 mL de agua adicionándola por las paredes del embudo,
agitando suavemente, hasta que el agua del lavado ya no dé reacción colorida
con la fenolftaleína. Después del último lavado, esperar de
B.22.5.3.5
Filtrar la solución lavada
en continuo a través de un filtro que contiene aproximadamente
B.22.5.3.6
Evaporar el disolvente en un
rotavapor a
B.22.5.3.7
Disolver el remanente
obtenido con 3 mL de la fase móvil y recolectar cuantitativamente la solución con
una jeringa de vidrio. Filtrar la solución a través de un filtro acrodisco de
0,45 µm a un matraz actínico de 10
mL. Lavar el matraz pera con porciones de 2 mL de fase móvil y repetir el mismo
procedimiento hasta llegar al aforo del matraz. Hacer lo mismo para cada filtro
de blanco, estándar y probar por duplicado.
Nota
5: Se recomienda
acondicionar el acrodisco de 0,45 m con metanol antes de utilizarlo en la filtración del recuperado.
B.22.5.4
Condiciones Cromatográficas.
B.22.5.4.1 Fijar los siguientes parámetros de acuerdo
con las instrucciones de operación del cromatógrafo.
Columna Octadecil ODS (20), tamaño de
partícula 5 m, longitud
Loop de inyección: 20 L.
Fase móvil: metanol: agua 95:5.
Flujo: 1 mL/min.
Detector: Longitud de onda ajustada a 325 nm.
Registrador: 5 mm/min.
B.22.5.5 Determinación
de Vitamina A.
Inyectar dos veces los siguientes analitos:
primero 20 L del blanco, después 20 L de la solución estándar para HPLC (20 UI/mL aprox.) y por último 20 L de la muestra (del saponificado).
B.22.5.5.1
En el cromatograma,
identificar el pico y tiempo de retención de la vitamina A correspondiente al
estándar. Con estos datos, identificar el pico y tiempo de retención de la
vitamina A contenida en la muestra.
B.22.5.5.2
Calcular el área o la altura
del pico de la solución patrón y de las muestras en los cromatogramas
obtenidos.
B.22.6
Cálculos.
El contenido de vitamina A, expresado en
Unidades Internacionales por L de producto es igual a:
![]()
En donde:
m = toma de ensayo en g o mL.
hP = altura del pico de la
muestra, en mm.
hS = altura del pico de la
solución estándar final, en mm.
C = concentración de la solución estándar
final inyectada, en UI/mL para la vitamina A.
V = volumen de solución estándar final, en el
cual ha sido diluido el remanente antes de la cromatografía.
Los resultados deben reportarse como g equivalentes de retinol.
B.22.7
Expresión de Resultados.
|
g equivalentes de retinol/ L 1 UI = 0,3 g equivalentes de retinol (todos los retinoles trans) |
B.23
Determinación de Vitamina D3 – HPLC
B.23.1
Fundamento
Saponificación alcalina de la muestra;
extracción con éter de compuestos insaponificables; evaporación del éter;
solución del residuo seco en hexano e inyección de una alícuota en columna
preparativa de HPLC (fase normal, Sílice). Colección del eluato que contiene la
fracción de vitamina D; evaporación de esta fracción a sequedad, disolución en
la fase móvil de HPLC (Analítica, Acetonitrilo: Cloruro de metileno:
Isopropanol), inyección en HPLC (fase reversa C18) y determinación de la
vitamina D con el pico máximo a 264 nm por calibración del estándar externo.
B.23.2
Preparación de la muestra.
En el caso de productos deshidratados
reconstituir con agua, de acuerdo con las instrucciones señaladas en la
etiqueta o
B.23.3 Material
B.23.3.1 Instalación HPLC isocrática
B.23.3.2 Uno o dos registradores
B.23.3.3 Balanza analítica, con capacidad de
B.23.3.4 Balanza de precisión, con capacidad
de
B.23.3.5 Estufa de laboratorio (para
productos con almidón)
B.23.3.6 Baño de agua con agitadores
magnéticos, 4 plazas
B.23.3.7 Evaporador rotatorio con elevador
rápido y baño
B.23.3.8 Matraces aforados, vidrio marrón,
tapón de vidrio de 5, 50 y 100 mL
B.23.3.9 Matraz de fondo plano, cuello corto,
vidrio marrón de 250 mL
B.23.3.10 Matraces, en forma de pera, vidrio
marrón de 10 y 500 mL
B.23.3.11 Embudo de separación cónico, vidrio
marrón, con llave de 500 mL
B.23.3.12 Embudo, vidrio marrón, diámetro
B.23.3.13 Tapones huecos hexagonales, vidrio
marrón
B.23.3.14 Refrigerante con macho y hembra,
manguito
B.23.3.15 Alargadera para introducción de gas
B.23.3.16 Filtro plisado mediano con diámetro
de
B.23.3.17 Pipeta aforada, con una marca de 2
mL
B.23.3.18 Jeringuillas de 1 y 5 mL
B.23.3.19 Aguja para jeringuillas
B.23.3.20 Cilindro para gas comprimido, nitrógeno
B.23.3.21 Monodetentor para gas comprimido, N2
B.23.3.22 Filtro de 0,45 µ de diámetro
B.23.3.23 2 Columnas de 5 µ, 4,6 X 250
B.23.3.24 Aparato de filtración
B.23.3.25 Filtro 0,5 µ
B.23.4 Reactivos
B.23.4.1
Colecalciferol, vitamina D3, cristalizada para fines bioquímicos (C27H44O)
B.23.4.2
Hidróxido de potasio en lentejas para análisis (KOH)
B.23.4.3
Alcohol etílico absoluto, para análisis (C2H5OH)
B.23.4.4
Hidroquinona (C6H4(OH)2)
B.23.4.5
Eter de petróleo para análisis intervalo de ebullición 40
B.23.4.6
Fenolftaleína en solución etanólica al 1%, indicador (C6H4OH)2COC6H4CO)
B.23.4.7
Diastasa (para productos de almidón)
B.23.4.7
2-propanol (CH3)2CHOH
B.23.4.8
n-hexano CH3(CH2)4CH3
B.23.4.9 Acetonitrilo
(CH3CN)
B.23.4.10
Diclorometano (CH2Cl12)
B.23.4.11
Sulfato de sodio anhídro para análisis (Na2SO4)
B.23.4.12
Nitrógeno (N2)
B.23.4.13 Acido ascórbico (C6H8O6)
B.23.4.14 Fase Móvil para HPLC
Preparativa, 2-propanol al
1% en n-hexano
Degasificar el n-hexano bajo presión reducida
y pasar a través un filtro. Mezclar 100 mL de diclorometano con 900 mL de
acetonitrilo degasificado.
B.23.4.15 Fase
Móvil Analítica, diclorometano: acetonitriloisopropano (10: 89: 1) para
HPLC analítica
Degasificar
Nota:
La proporción
diclorometano/acetonitrilo debe adaptarse de modo que la vitamina D3 dé un
tiempo de retención de aproximadamente 8-9 min. Sin embargo no debería rebasar
20:100.
B.23.4.16 Fase
Móvil para lavar
Mezclar 100 mL de 2-propanol con 900 mL de
n-hexano degasificado.
B.23.4.17 Solución
Patrón de Vitamina D3 para HPLC preparativa
En un matraz aforado de 100 mL, pesar
exactamente 50,0 mg de colecalciferol (D3) cristalizado, disolver en n-hexano y
llevar al volumen con el mismo disolvente (= solución de 20,000 U.I./ mL).
Diluir esta solución 1000 veces con el mismo
disolvente para obtener una solución de 20 U.I./ mL . Esta solución permanece
estable de
B.23.4.18 Solución
Patrón de Vitamina D3 para HPLC Analítica
Evaporar 2 mL de solución patrón de 20 U.I./
mL (B.20.4.4) y tomar el residuo en 2 mL de fase móvil (B.20.4.2).
B.23.5 Procedimiento
Notas: La vitamina D3 es sensible a la luz.
Utilizar material de vidrio marrón o proteger el material corriente con papel
aluminio.
Efectuar todas las evaporaciones de disolventes
bajo presión reducida a una temperatura máxima de
Al final de la jornada, lavar la columna
preparativa durante 15 min con 2-propanol al 10% en n-hexano (B.20.4.3) con un
caudal de 2 mL /min.
B.23.5.1 Toma
de Ensayo
Mezclar o moler la muestra a fin de
homogeneizarla por completo. Pesar, con una precisión de 10 mg, una toma de
ensayo que contenga 20-40 U.I. de vitamina D3.
B.23.5.1.1 Productos
con Almidón:
En un matraz redondo de fondo plano de 250 mL
con cuello esmerilado, mezclar la toma de ensayo con 10% de su peso de
diastasa. Añadir máximo 30 mL de agua destilada a 45-
B.23.5.1.2 Productos
sin Almidón:
En un matraz redondo de fondo plano de 250 mL
con cuello esmerilado, mezclar la toma de ensayo con máximo 30 mL de agua
destilada a 45-
B.23.5.2 Saponificación
Añadir
A continuación añadir 60 mL de alcohol
absoluto y
Montar sobre el matraz una alargadera para
introducción de un gas refrigerante. Introducir una ligera corriente de gas
nitrógeno, y calentar durante 30 min a
Nota: Durante la saponificación, asegurar una
buena agitación del medio de reacción.
B.23.5.3 Extracción del
Insaponificable
Una vez terminada la saponificación, enfriar
el matraz a temperatura ambiente y transvasar la suspensión a un embudo de
separación de 500 mL.
Enjuagar con máximo 30 mL de agua fría en 3
porciones de 10 mL que se añaden al contenido del embudo de separación. Evitar
un exceso de agua, ya que favorece la formación de emulsiones.
En seguida enjuagar el matraz con 50 mL de
éter de petróleo (rango de 40-
Vaciar la fase acuosa a otro embudo de
separación de 500 mL. Recojer la fase orgánica en un tercer embudo de
separación de 500 mL.
Efectuar esta extracción 5 veces en total.
Haciendo las agitaciones con mucho cuidado para evitar emulsiones.
Lavar la solución orgánica con porciones de
100 mL de agua adicionándola por las paredes del embudo, sin agitar, hasta que
el agua de lavado ya no dé reacción coloreada con fenolftaleína. Después del
último lavado, esperar al menos 15 min antes de vaciar la fase acuosa.
Filtrar la solución lavada en continuo a
través de un filtro que contiene aproximadamente
Evaporar el disolvente bajo presión reducida
en un rotavapor a
Transvasar el residuo cuantitativamente a un
matraz aforado de 5 mL, mediante pequeñas porciones de fase móvil (B.20.4.1)
llevar al volumen y filtrar la solución inmediatamente a través de un filtro de
0,45 µ de tamaño de poro y adecuado para solventes orgánicos, por ejemplo
Acrodisc - CR o equivalente; recoger el filtrado en un matraz en forma de pera.
El filtrado debe ser límpido.
La solución está lista para la cromatografía.
B.23.5.4 Cromatografía
Preparativa
Condiciones:
|
Columna |
Spherisorb Si, 5 mcm, 4,6 X |
|
Loop
de inyección |
500
µl |
|
Fase
móvil |
1%
2-propanol en n-hexano (B.2.3.1) |
|
Caudal |
1-3
mL/min (el tiempo de retención de la vitamina D3 debe ser de aproximadamente
5 min |
|
Detector |
espectrofotómetro,
longitud de onda variable, ajustada a 264 nm (o eventualmente
espectrofotómetro de longitud de onda fija a 254 nm, únicamente utilizable
para la etapa preparativa), 0,05 AUFS para el patrón y 0,5 AUFS para el
extracto de muestra |
|
Registrador |
10
mm/min |
Inyectar primero 500 µl de solución patrón de
vitamina D3 (B.20.4.4) y determinar el tiempo de retención: debe ser
aproximadamente 5 min. Inyectar a continuación la solución de la muestra
obtenida bajo el numeral B.20.5.3 y recoger la fracción que contiene la
vitamina D3 en un matraz en forma de pera de 10 mL. Comenzando a recoger
aproximadamente 1 min antes de la elución de la vitamina D3 y parar
aproximadamente 1 min después de la elución de la vitamina D3.
B.23.5.5 Cromatografía Analítica
Evaporar a seco la fracción recogida bajo
20.5.4, mediante una ligera corriente de nitrógeno.
Enfriar el matraz a fin de evitar errores de
volumen a una evaporación eventual de disolvente; luego tomar el residuo en 300
µl de fase móvil (B.20.4.2), agitar ligeramente para disolver bien el residuo.
Condiciones:
|
Columna |
Spherisorb ODS, 5 mcm, 4,6 X |
|
Loop
de inyección |
100
µl |
|
Fase
móvil |
10%
diclorometano, 89% acetonitrilo y 1% de 2-propanol |
|
Caudal |
2
mL/min |
|
Detector |
espectrofotómetro,
longitud de onda variable, ajustada a 264 nm; 0,01 AUFS |
|
Registrador |
10
mm/min |
Inyectar primero 100 µl de solución patrón
(B.20.4.5) y determinar el tiempo de retención: debe ser aproximadamente 8-9
min (adaptar la proporción de diclorometano/acetonitrilo si es necesario).
Luego inyectar 100 µl de la fracción obtenida bajo B.20.5.4.
B.23.6 Cálculo,
Expresión e Interpretación de los Resultados
B.23.6.1 Evaluación
Identificar el pico de la vitamina D3 en el
cromatograma de la muestra mediante el tiempo de retención definido por
cromatografía de la solución patrón. Medir la altura de los picos obtenidos
durante la cromatografía de la solución patrón y de la solución muestra.
El contenido en vitamina D3, expresado en
Unidades Internacionales por
hp
x C x Vo x V2
x 100
Hs x
m x V1
En donde:
m = toma de ensayo, en gramos
hp = altura del pico de la muestra, en mm
hs = altura del pico de la solución patrón, en mm
C = concentración de la solución patrón
inyectada, en U.I./ mL
Vo = volumen en el cual ha sido diluido el residuo antes de la
cromatografía preparativa (20.5.3) (en general 5 mL= matraz aforado)
V1 = volumen del extracto inyectado en la columna preparativa (en general
0,500 mL=volumen del loop de inyección)
V2 = volumen en el cual ha sido diluida la fracción después de la
cromatografía preparativa (en general 0,300 mL)
Nota: es superfluo un factor de corrección para la
isomerización de la vitamina D3, en previtamina D3, ya que este fenómeno es
despreciable en las condiciones de saponificación aplicadas.
B.23.6.2 Límite de Detección de
Acuerdo a
Aproximadamente: 20 U.I./100 g
B.23.6.3 Repetibilidad
La diferencia entre dos resultados
individuales obtenidos con la misma muestra para ensayo, en las mismas
condiciones (analista, aparato, laboratorio) en un corto intervalo de tiempo,
no debe exceder 10% de la media entre ambos resultados.
Cuando las vitaminas han sido añadidas por
mezcla en seco, la repetibilidad está fuertemente influida por el grado de
homogeneidad del producto.
APENDICE INFORMATIVO A
A. LISTA DE SUSTANCIAS
DESINFECTANTES RECOMENDADAS
|
No. |
Solución
acuosa de: |
Concentración
máx. del ingrediente activo |
Condiciones de
empleo |
|
1 |
Hipoclorito cálcico, sódico o potásico, con o
sin bromuro cálcico, sódico o potásico. |
200 mg/kg de halógeno calculado en cloro. |
Escurrir después del tratamiento. No precisa aclarado final |
|
2 |
Acido di y tricloroisocianúrico, o sales
potásicas o sódicas de estos ácido con o sin bromuro potásico, cálcico o sódico. |
100 mg/kg de halógeno calculado en cloro. |
Como en 1 |
|
3 |
Yoduro potásico, p-toluensulfocloramida
sódica y lauril sulfato sódico. |
25 mg/kg de yodo valorable; el nivel de los
componentes no debe superar el mínimo preciso para obtener el efecto
funcional deseado. |
Como en 1 |
|
4 |
yodo butoxi-monoéter de etilenglicol +
butoximono-éter de propilenglicol+ butoximonoéter de polialquilenglicol,
teniendo un punto de niebla de 90- Monoetil-éter de dietilenglicol se puede
adicionar como componente opcional. |
25 mg/kg de yodo. Los adyuvantes utilizados
con el yodo no deben de superar la cantidad mínima necesaria para obtener el
efecto funcional deseado. |
Como en 1 |
|
5 |
Yodo, ácido hidroyódico alfa-
(p-monofenil-W-hidroxipolil (oxietileno) (peso molecular medio 748) y/o
polioxietilen-polioxipropileno tipo copolimerización en bloque (peso
molecular medio mínimo 1,90). Alcohol isopropílico se puede adicionar como
componente opcional. |
Como en 4 |
Como en 1 |
|
6 |
Yodo, yoduro de sodio, dioctilsulfosuccinato
de sodio y polioxietilen-polioxipropileno tipo copolimerización en bloque
(peso molecular medio mínimo 1,900). |
Como en 4 |
Como en 1 |
|
7 |
Acido dodecilbencenosulfónico,
polioxietilen-polioxipropileno, tipo copolimerización en bloque (peso
molecular medio mínimo 2,800). |
400 mg/kg de ácido dodecil-benceno-sulfónico
y 80 mg/kg de polioxietilen-polioxipropileno, tipo copolimerización en bloque
(peso molecular medio mínimo 2,800). |
Estas soluciones se emplean en la limpieza de
equipo y utensilios, así como en botellas y envases para leche; no precisan
aclarado final.* |
|
8 |
Yodo, butoxi-monoéter de etilen
glicol+butoxi-monoéter de propilenglicol+butoximono-éter de
polialquilenglicol, con un peso molecular medio mínimo de 2,400, y
alfa-lauril-W-hidroxipoli (oxietileno) con un promedio de 8-9 moles de óxido
de etileno y un peso molecular medio de 400. |
Como en 4 |
Estas soluciones se emplean en la limpieza
del equipo y utensilios, así como de envases de leche y otras bebidas. Como
aclarado preliminar se puede utilizar agua a la que se ha añadido esta
solución. No se debe emplear en el enjuagado final.* |
|
9 |
Cloruro de n-alquil-(C12 a C18)
bencildimetil-amonio, con un promedio de peso molecular de 351-380 y
conteniendo principalmente cadenas de los grupos alquilo con |
200 mg/kg de compuestos de amonio cuaternario
activos. |
Como en 1 |
|
10 |
Tricloromelamina y lauril sulfato sódico o
ácido dodecilbenceno sulfónico. |
Tricloromelamina, en cantidad no superior a
la necesaria para producir 200 mg/kg de cloro y lauril sulfato sódico, a un
nivel que no exceda del mínimo requerido para que se presente el efecto
funcional deseado o, ácido dodecilbenceno sulfónico en proporción no superior
a 4000 mg/kg |
Estas soluciones se emplean en la limpieza de
envases para bebidas, excepto leche, así como en la higienización del equipo
y utensilios y otros materiales, que puedan contactar con alimentos. No
precisan aclarado final.* |
|
11 |
Volúmenes iguales de cloruro de n-alquil (C12
a C18) bencildimetilamonio y cloruro de n-alquil (C12 a
C18) dimetilbencilamonio, con un peso molecular medio de 384. |
200 mg/kg de compuestos de amonio
cuaternarios activos. |
Estas soluciones se utilizan en el
tratamiento de equipo y utensilios, así como las superficies que contactan
los alimentos, en establecimientos de comidas públicas. No precisan aclarado
final.* |
|
12 |
Sal sódica del ácido oleico sulfonatado,
polioxietileno-polioxipropileno tipo copolimerización en bloque, con un peso
molecular medio de 2,000 y con |
200 mg/kg de ácido sulfonatado, sal sódica. |
Esta solución se utiliza para botellas u
otros envases de vidrio para leche, así como para el equipo y utensilios
empleados en la elaboración de alimentos. Los artículos tratados con esta
solución se deben escurrir durante 15 min antes de ponerlos en contacto con
los alimentos. No precisa aclarado final.* |
|
13 |
Yodo y alquil (C12 - C15)
monoéter de etilen y propilenglicol+ monoéter de polialquilenglicol, con un
punto de niebla de 70- |
Como en 4 |
Como en 1 |
|
14 |
Yodo, butoxi-monoéter de etilen y
propilenglicol+butoximonoéter de polialquilenglicol, con un punto de niebla
de 90- |
Como en 4 |
Como en 1 |
|
15 |
Hipoclorito de litio |
290 mg/kg de cloro y 30 mg/kg de litio. |
Como en 1 |
|
16 |
Cantidades iguales de cloruro de n-alquil (C12-C18)
bencil-dimetil-amonio y cloruro de n-alquil (C12 a C14)-dimetil-(etil-bencil)-amonio
(con pesos moleculares medios de 377-384). De forma opcional se puede
adicionar etilen-diaminote-tracetato tetrasódico y/o -(p-nonil-fenol)-w-hidroxipoli (oxietileno con un contenido de 11
moles. |
200 mg/kg de compuestos de amonio cuaternario
activo. |
Como en 1 |
|
17 |
Cloruro de di-n-alquil (C8 - C10)-dimetilamonio
y alcohol isopropílico, con un peso molecular medio de 332-361 |
150 mg/kg de compuestos de amonio cuaternario
activo. |
Como en 1 |
|
18 |
Cloruro de n-alquil (C12 -C18)
bencil-dimetil-amonio, metaborato sódico, -terpinol y - [ p-(1,1,3,3 tetrametil-butil)fenil]-w-hidroxipoli (oxietileno),
producido con 1 mol de fenol y 4-14 moles de óxido de etileno |
200 mg/kg de compuestos de amonio cuaternario
activos y 66 mg/kg de - [(1,1,3,3 tetrametil-butil)fenil] w-hidroxipoli (oxietileno). |
Como en 1 |
|
19 |
Di-cloro-iso-cianurato sódico y
etilen-diamino-tetracetato tetrasódico. |
100 mg/kg de cloro. |
Como en 11 |
|
20 |
o-fenil-fenol, o-bencil-p-cloro fenol, p-amilfenol,
sulfato de -alquil- (C12 a C15)-w- hidroxipoli-
(oxietileno) y sodio con un contenido medio de polioxietileno de 1 mol, sales
potásicas de ácidos grasos de aceite de coco y alcohol isopropílico o
hexilenglicol. |
800 mg/kg de fenoles activos totales, que
comprenden 400 mg/kg de o-fenil-fenol 320 mg/kg de o-bencil-p-clorofenol y 80
mg/kg de p-amifenol terciario. |
Unicamente para aplicaciones de un solo uso. |
|
21 |
Dodecil-benceno-sulfonato sódico. |
Entre 25 y 430 mg/kg del producto. |
Como en 1 |
*En otros países, entre los que no se incluyen
Estados Unidos, es obligatorio el aclarado final con agua después de aplicar la
solución desinfectante.
Los fabricantes podrán emplear otras
sustancias para la limpieza y desinfección de equipo, siempre y cuando se
asegure que los productos obtenidos son inocuos para el consumidor.
APENDICE INFORMATIVO B
B.1 PROCEDIMIENTO DE LIMPIEZA Y
DESCONTAMINACION DEL MATERIAL DE VIDRIO Y AREA DE TRABAJO PARA
B.1
Objetivo
Por la naturaleza y potenciabilidades tóxicas
de las aflatoxinas es importante establecer directrices para la
descontaminación del área de trabajo, material y equipo utilizados, así como
los procedimientos a seguir para neutralizar derrames y remanentes de extractos
de las muestras.
El trabajo de limpieza y descontaminación
será realizado por personal capacitado y que cuente con equipo protector como
una bata, guantes impermeables y lentes protectores.
B.2
Descontaminación del Material de Laboratorio
Todo el material de vidrio del laboratorio
que haya sido utilizado durante el análisis debe sumergirse en una solución de
hipoclorito, el cual se prepara diluyendo una parte de solución comercial de
hipoclorito de sodio o clarasol (con una concentración entre 5 y 6%) con 10
partes de agua, por ejemplo mezclar 100 mL de blanqueador comercial con 1000 mL
de agua.
Después del tratamiento, el material debe
enjuagarse abundantemente con agua corriente seguido de agua destilada, secar
por escurrimiento o en estufa de 90-
B.3
Descontaminación del Area de Trabajo
La superficie de las mesas de trabajo y las
paredes en las que pudiera haberse contaminado de leche con aflatoxinas, deben
limpiarse con una toalla desechable impregnada en solución de hipoclorito de
sodio o solución blanqueadora comercial después de cada sesión.
B.4
Descontaminación de Material Desechable
Todo el material desechable como son las
columnas y placas deben sumergirse durante un mínimo de 5 min en una solución
de hipoclorito de sodio utilizando una parte de blanqueador comercial y diez
partes de agua. La solución descontaminadora ya usada debe eliminarse por el
drenaje y los materiales desechables tratados deben empacarse en una bolsa de
plástico sellada para colocarse en el depósito de desechos.
B.5
Tratamiento de Derrames
Los derrames de soluciones de aflatoxinas
deben tratarse inmediatamente con hipoclorito de sodio o blanqueador doméstico
y vertirlo directamente del envase, recoger los líquidos con un papel
absorbente, el cual también se colocará en una bolsa de plástico.
B.6
Tratamiento de Remanentes de Extracto de Muestras
Una vez que se ha separado una alícuota del
extracto de la muestra es frecuente que permanezca un remanente del mismo.
Estos restos de extractos deben tratarse con una cantidad de blanqueador
equivalente a la unidad del volumen del residuo a tratar. Los líquidos
resultantes se deben acumular en un recipiente para desechos líquidos y
eliminarse en un lugar destinado especialmente para este propósito.